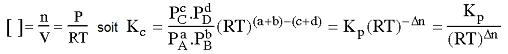
Suivant les phases en présence, le système étudié est un équilibre homogène (une seule phase
liquide ou gazeuse)
ou
hétérogène (présence d'une phase solide avec la phase liquide ou gazeuse).
Loi d'action de masse relative aux équilibres homogènes
Soit la réaction suivante :
a A + b B
|
|
[C]c.[D]d |
Pcc.Pdd | |
|
par définition |
Kc = ————— |
et |
Kp = ————— |
|
[A]a.[B]b |
Paa.Pbb |
Kc et Kp sont appelées constantes d'équilibre de la réaction.
Kc et Kp ne sont fonction que de la température.
Remarque : pour les pressions partielles (donc pour les gaz parfaits)
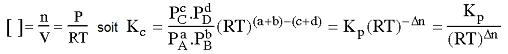
|
|
Kp |
|
|
On obtient la relation : |
Kc = ——— |
|
|
(RT)Δn |
LOI D'ACTION DE MASSE RELATIVE AUX ÉQUILIBRES HÉTÉROGÈNES
Dans le cas des équilibres hétérogènes, on ne fait intervenir dans l'expression de la constante
d'équilibre que les
constituants de la phase gazeuse (ou liquide).
Les exercices sont proposés dans la partie
"connaissances" de ce cours.