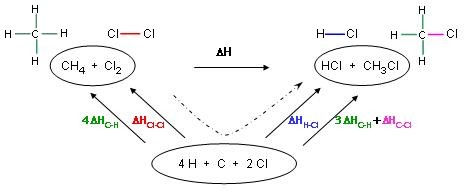
Un cycle à 3 étapes permet de résoudre le problème.
En effet, on écrit la
réaction (étape 1) et centré au dessous, les
atomes
libres.
Partant des atomes libres
vers les réactifs, on doit identifier les liaisons
créées (étape 2).
Partant des atomes libres
vers les produits, on doit identifier les liaisons
créées (étape 3).
L'écriture de la réaction permet de construire le
cycle.
Cliquer sur la figure pour afficher la présentation initiale

La réaction peut être décrite comme la rupture d'une liaison C-H et d'une
liaison Cl-Cl puis
la formation d'une liaison C-Cl et d'une liaison H-Cl.
L'enthalpie de la réaction est égale à la somme des enthalpies de liaison des
produits moins la
somme des enthalpies de liaison des réactifs.
Soit : ΔH0réaction = (ΔHH-Cl + 3 ΔHC-H
+ ΔHC-Cl) - (4 ΔHC-H + ΔHCl-Cl)
= ΔHH-Cl + ΔHC-Cl - ΔHC-H - ΔHCl-Cl
= (-432) + (-328) - (- 411) - (- 238) = - 111 kJ
b- La deuxième question se traite comme la première mais avec les enthalpie de formation.
Un cycle à 3 étapes permet de résoudre le problème.
En effet, on
écrit la réaction (étape 1) et centré au dessous, la liste de tous
les corps simples
nécessaires à la formation des réactifs ou des produits.
Partant des corps simples
vers les réactifs, on doit identifier les corps
simples nécessaires à la
formation de chaque réactif (étape 2) et de même pour les
produits (étape 3).
L'écriture de la réaction permet de construire le
cycle.
Cliquer sur la figure pour afficher la présentation initiale
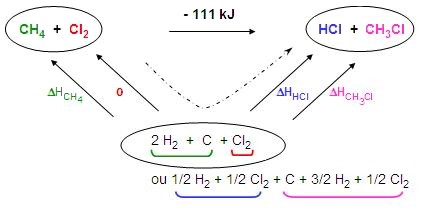
L'enthalpie de la réaction est égale à la somme des enthalpies de formation des
produits moins la
somme des enthalpies de formation des réactifs.
L'inconnue n'est plus l'enthalpie de réaction (calculée à la question
précédente) mais l'enthalpie de
formation d'un produit (CH3Cl).
L'écriture de l'équation est semblable à la précédente :
Soit : ΔH0réaction = - 111 = (ΔHHCl + ΔHCH3Cl)
- (ΔHCH4 + 0)
- 111 = [ (- 92) + ΔHCH3Cl ] - (- 75)
ΔHCH3Cl = - 94 kJ
c- Pour répondre à la question, il faut d'abord proposer une réaction dont on
connait l'enthalpie et qui
fait intervenir l'enthalpie de liaison H-H. Seule la formation de HCl
correspond.
La réaction ne doit pas faire intervenir le carbone car on ne connait pas son
enthalpie de
transformation en atomes libres.
On lui applique la méthode précédente (cycle à 3 étapes).
Cliquer sur la figure pour afficher la présentation initiale
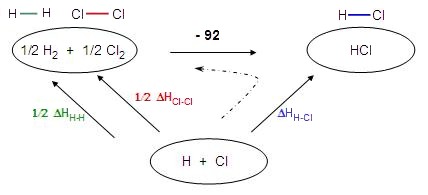
Soit : 1/2 ΔHH-H + 1/2 (- 238) = (- 432) - (- 92)
ΔHH-H = - 442 kJ
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.