| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

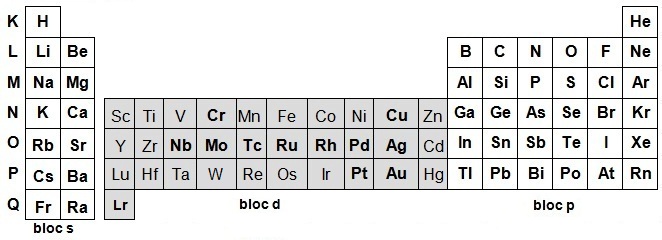
ÉTUDE DES FAMILLES D'ÉLÉMENTS : le bloc d
Connaissances ... nommer et situer ... les propriétés des familles du bloc d ...
Le bloc d est particulier car il présente une certaine homogénéité et parallèlement, il contient des éléments qui se distinguent fortement des autres éléments de la classification :
- les familles auront donc des propriétés proches mais différents phénomènes (énergétiques, structuraux, …) seront en compétition
- tous les métaux du bloc d sont ductiles et brillants, ils sont caractérisés par un éclat métallique argenté sauf le cuivre et l’or (respectivement rouge-brun et jaune)
- ils sont malléables, c'est-à-dire qu’ils peuvent être réduits en feuillets par martelage, l’élément le plus malléable étant l’or
Les éléments d sont bons conducteurs électriques (contiennent les trois meilleurs Cu, Ag et Au loin devant l'ensemble des éléments) et thermiques, ils présentent des points de fusion élevés (W, Os, Re, Ta bien que B et C soient les plus réfractaires) et les densités les plus élevées (Os, Pt, W, Au, U …).
Dans la croûte terrestre, ils sont présents par le Fe (4ème), le Ti (10ème) et le Mn (12ème) et en quantité peu importante mais non négligeable par dans l’ordre Zr, V, Cr, Ni, Zn, Y, Co, Sc, Nb ....
Au contact de l’atmosphère, ils se recouvrent d’une fine pellicule d’oxyde qui protège le métal d’attaques chimiques dans des conditions
standards (sauf le Fer).
Certains présentent des anomalies dans leurs propriétés électriques (supraconductivité V et Nb) et magnétiques (ferromagnétisme des
éléments Fe, Co et Ni = aimants permanents).
La caractéristique la plus importante des éléments d est la gamme étendue de leur état d’oxydation.
Le D.O. le plus répandu est + II, car il correspond à la perte des deux électrons de la sous couche s.
Les éléments Mn (0, +II à +VII),
Ru (-II, 0, +II, à +VIII) et Os (0, +II, à +VIII) sont ceux qui ont le plus grand nombre
d'états d’oxydation.
Les oxydes des éléments d sont acides, basiques ou amphotères.
Une caractéristique à noter, les degrés d’oxydation inférieurs donnent un caractère
réducteur à l’espèce considérée (elle peut
donner des électrons), tandis que les états d’oxydation supérieurs donnent un caractère oxydant (elle va prendre des électrons).
Avec l’oxygène et les halogènes, les éléments d forment de nombreux composés binaires et ternaires (pérovskites, spinelles, …).
La chimie des complexes concerne les éléments d, ce sont des molécules résultant de l’association d’un ion métallique et de un ou plusieurs ligands (ions : F-, O2- ; molécules ou ions diatomiques CO, CN- ; molécule polyatomique C6H6, H2O) mais ils conduisent à deux types de chimie :
- la chimie organométallique traite uniquement des complexes à liaisons métal-carbone fortement covalentes (R-MgX) dans
lesquels l’ion métallique est à un degré d’oxydation faible (0, +I) comme les organomagnésiens RMgX
- la chimie de coordination traite des complexes pour lesquels la liaison métal-ligand est plus ionique et où les métaux ont des
degrés d’oxydation plus élevés (+II, +III) comme ce complexe du Rhodium [Rh(CO)2I2]-
Certains complexes ont révolutionné la chimie, en particulier dans la pétrochimie, leur utilisation a permis d’obtenir une meilleure efficacité, une meilleure sélectivité et des conditions de réaction plus douces que celles réalisées en catalyse hétérogène.
Plus de vingt procédés industriels utilisent des complexes solubles : hydrogénation, oxydation des hydrocarbures, polymérisation des oléfines, synthèse des aldéhydes et des alcools, …
| Pr Robert Valls | robert.valls@univ-amu.fr |