| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

ÉTUDE DES FAMILLES D'ÉLÉMENTS : le bloc p
Connaissances ... nommer et situer ... la famille du carbone ou colonne 14 ...
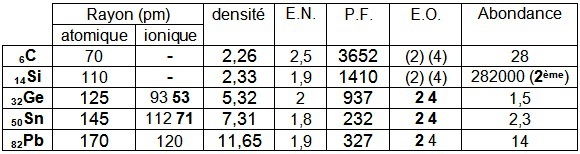
La famille du carbone est très hétérogène car formée de non métaux (C), de métalloïdes (Si et Ge) et de métaux (Sn et Pb).
Les éléments de la famille du carbone ne donnent pas toujours des ions.
Les chimies des hydrures du silicium et du carbone diffèrent du fait de la polarisation opposée de la liaison :
C-H 2,5 / 2,2 (électronégativité de H inférieure) et Si-H 1,9 / 2,2 (électronégativité de H supérieure) aussi leurs
dérivés auront des propriétés différentes.
Le carbone se présente sous différentes formes, le graphite, le diamant et il est présent dans l’anthracite (94%), la houille (70 à 90%), le lignite (65%) et la tourbe (60%).
Le graphite est réfractaire (creusets), lubrifiant, chimiquement résistant et conducteur (électrodes). Il est 100 000 fois plus conducteur dans le sens du plan des feuillets que perpendiculairement. Le diamant artificiel est obtenu sous 50 kbar et à 1200°C et il est plus dur que le naturel.
L’anthracite est un charbon très riche en carbone. La houille donne le coke par élimination des volatils (20 h à 1200°C).
Le lignite c’est formé au tertiaire par fossilisation de végétaux et la tourbe est de formation récente dans les marais.
Le carbone et le monoxyde de carbone sont utilisés comme réducteurs par transformation en CO ou CO2
et réduisent la plupart des oxydes métalliques selon : MO + C → M + CO et MO + CO → M + CO2
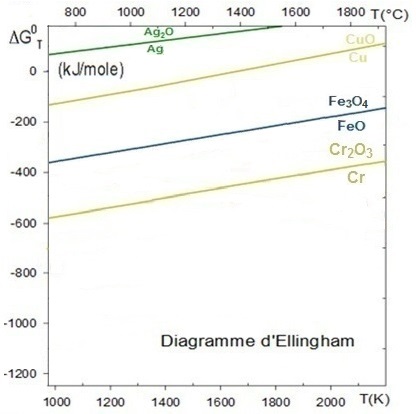
Le diagramme d’Ellingham donne l'évolution de l'enthalpie libre d'une réaction (ici d'oxydation de métaux) en fonction de la température
et permet de choisir la température à laquelle les oxydes peuvent être réduits et surtout s'ils peuvent être réduits par un autre métal.
|
La courbe de l'équilibre Ag + ½ O2 → Ag2O est au dessus de celle de l'équilibre Cu + ½ O2 → CuO aussi, lorsque l'on met en présence Cu avec Ag2O, le cuivre s'oxyde et réduit l'oxyde d'argent, de même, le fer réduit l'oxyde de cuivre et le chrome réduit l'oxyde de fer.
On peut superposer les courbes correspondant
au carbone Ces courbes sont particulières car l'équilibre |
On observe que la courbe de l'équilibre C + ½ O2 → CO est la seule à présenter une pente négative, en effet, le nombre de mole de gaz augmente de gauche à droite contrairement à par exemple Cu + ½ O2 → CuO où il diminue. Le carbone est donc un réducteur très puissant mais il n'est pas parfait car il donne souvent des carbures avec les métaux (ce qui les fragilise).
Remarque : La réduction de l’oxyde de fer dans les hauts fourneaux permet de produire de la fonte par une succession de réactions que l'on présente le plus simplement possible.
vers 500°C
2 Fe2O3 + CO ![]() 2 Fe3O4 + CO2
2 Fe3O4 + CO2
entre 600 et 900°C Fe3O4 + CO
![]() 3 FeO + CO2
et FeO + CO
3 FeO + CO2
et FeO + CO
![]() Fe + CO2
Fe + CO2
entre 1300 et 1500°C 3 Fe + C ![]() Fe3C
on obtient la fonte Fe3C qui sera traitée pour donner les aciers
Fe3C
on obtient la fonte Fe3C qui sera traitée pour donner les aciers
| Pr Robert Valls | robert.valls@univ-amu.fr |