| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... la fraction ionique ...
L'électronégativité permet de définir la fraction ionique (FI) ou pourcentage d'ionicité d'une liaison par la formule suivante :
fraction ionique = FI = (χB - χA ).100 / χB
si FI tend vers 0, la liaison est majoritairement covalente
si FI tend vers 1, la liaison est majoritairement ionique
si FI est voisine de 0,5 alors la liaison est de type intermédiaire (on considère généralement 0,4 à 0,6), l'ionicité est proche de 50%.
A noter que les seules liaisons 100% covalentes sont celles qui constituent les corps simples et qu'une liaison 100% ionique n'est pas possible (il faudrait que l'un des éléments ait une électronégativité nulle et l’autre une électronégativité très grande).
Le maximum est observé pour le fluorure de francium avec 82,5% d'ionicité avec respectivement des électronégativités de 4 et 0,7.
Le caractère exclusivement donneur des métaux conduit au fait que si un métal est engagé dans une liaison chimique non métallique, il est toujours donneur et jamais accepteur (DOmétaux > 0).
Dans la liaison métallique, il n'est plus question de donneur ni d'accepteur, puisque cette liaison résulte d'une mise en commun par
délocalisation complète des électrons.
Les métaux ne subissent pas de réactions chimiques entre eux, ils forment des alliages.
Le fluor étant le plus électronégatif des éléments, il ne pourra jamais être donneur d'électrons et ne pourra donc pas présenter un DO positif.
Le fluor donnera des liaisons ioniques avec tous les métaux, mais par exemple, l'hydrogène pourra en donner également mais seulement
avec les alcalins (LiH, NaH, ...).
On voit aussi que les non métaux ne pourront donner entre eux que des liaisons covalentes sauf dans certains cas, avec le fluor.
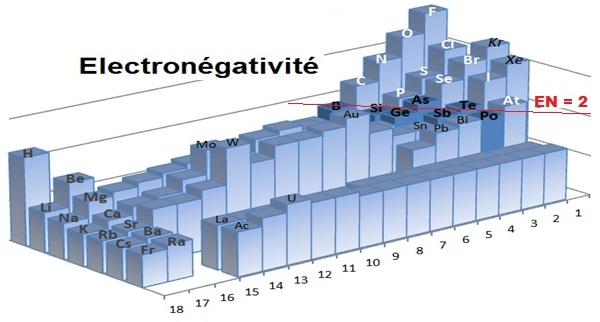 |
Le calcul de la fraction ionique demande une bonne visualisation de l’électronégativité qui peut être présentée sous différents diagrammes que l’on doit mémoriser. La figure ci-contre permet de Seuls quelques éléments de transition |
| Pr Robert Valls | robert.valls@univ-amu.fr |