PROPRIÉTÉS ET STRUCTURE DES VERRES
Définir... Influence des oxydes métalliques sur les propriétés des verres
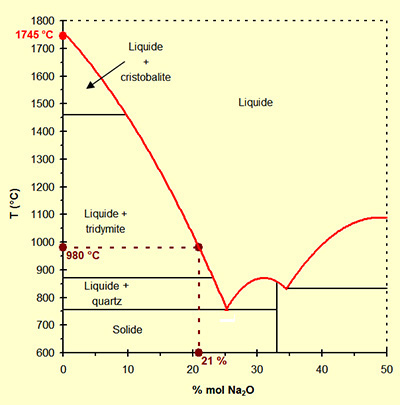
Le diagramme simplifié du système binaire SiO2 - Na2O présenté
figure ci-contre montre l'influence manifeste de l'oxyde de sodium
sur la température de fusion du mélange.
Alors que la silice pure à une température de fusion voisine de
1745 °C, un mélange de silice avec 21 % en moles d'oxyde de
sodium a une température de fusion d'environ 980 °C, soit une baisse
de 765 °C.
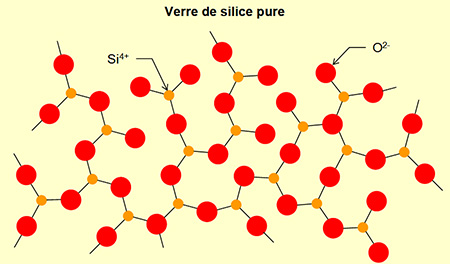
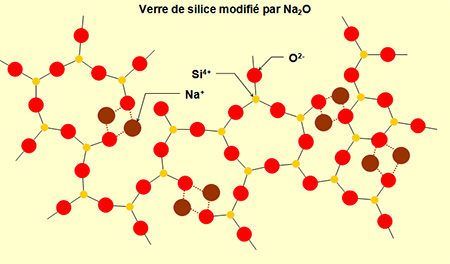
La présence du sodium va modifier le réseau aléatoire continu de la
silice du verre. Les atomes de sodium pénètrent dans le réseau en
"ouvrant" certaines mailles et se lient à des atomes d'oxygène.
La liaison Na-O étant plus faible que la liaison Si-O, cela fait baisser
la viscosité et la température de fusion (voir
figure ci-dessous).
Les atomes d'oxygène apportés par Na2O vont eux s'intégrer au
réseau, en se combinant aux atomes de silicium.
Si le rapport molaire O / Si devient un peu trop fort (> 2,5), de nouvelles
liaisons apparaissent dans le réseau qui devient alors plus rigide, et la
solidification conduit à un produit cristallisé.
Pour obtenir une structure vitreuse il faut donc utiliser des conditions
particulières de refroidissement (vitesse très élevée).
(structures représentées uniquement en 2D)
peuvent entrer dans cette catégorie : certains alliages métalliques, liquides moléculaires, polymères ...
Ici nous ne parlerons que des verres "classiques" dont le constituant principal est la silice (SiO2). Cette silice est associée à d'autres
oxydes, qui permettent d'abaisser sa température de fusion par formation d'eutectiques, et d'obtenir des propriétés physiques
particulières. Les principaux oxydes utilisés sont : Na2O, BaO, CaO, Al2O3, B2O3, MgO, PbO.
Les liaisons covalentes, qui sont des liaisons fortes, étant nombreuses ( ≈ 50 %), la température de fusion de la silice est élevée
(> 1700 °C).
Un ajout modéré de métaux alcalins ou alcalino-terreux, qui ont une valence plus faible que le silicium (Si4+ : 4; Na+ : 1; Ca2+ : 2), conduit à la formation de liaisons Métal-O à caractère ionique plus marqué, donc moins fortes, ce qui fait baisser nettement la
température de fusion. Par exemple, une liaison ionique Na-O, est environ 5 fois plus faible qu'une liaison ionocovalente Si-O.
Les verres les plus courants sont les sodocalciques de composition : SiO2 + Na2O + CaO + quelques additifs. L'oxyde de sodium permet d'abaisser la température de fusion et l'oxyde de calcium augmente la résistante chimique.
(partie qui nous intéresse ici)