PROPRIÉTÉS ET STRUCTURE DES VERRES
Définir... Structure des verres et phénomène de transition vitreuse
Les verres sont des matériaux amorphes obtenus le plus souvent par solidification d'un mélange de composés fondu à une
température élevée, puis refroidi. Le terme amorphe signifie que le matériau n'a pas une structure régulière avec un arrangement périodique des atomes sur une longue distance, comme c'est la cas pour les matériaux cristallins. Dans un verre, l'absence de
cristallisation est favorisée par trois facteurs : une viscosité suffisante (100 à 1000 Pa.s), une vitesse de refroidissement importante et l'absence de germes de nucléation.
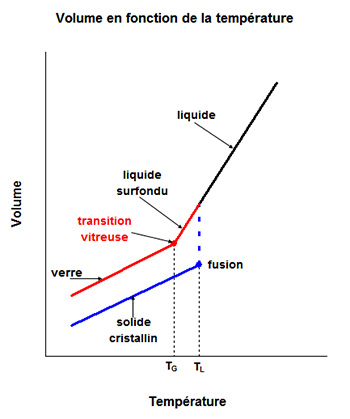
Un phénomène particulier distingue les verres d'autres solides amorphes : la transition vitreuse. Ce phénomène est illustré sur la
figure ci-dessous, qui présente l'évolution du volume en fonction de la température d'un matériau hypothétique, qui à l'état solide peut être soit
sous forme de verre, soit sous forme cristalline.
Pour le solide cristallin, on considère le cas le plus général où le volume augmente lors de la fusion.
Considérons tout d'abord le refroidissement d'un solide fondu conduisant à
un solide cristallin.
Au cours de la baisse de température, le volume diminue avec une pente p1.
Arrivé à la température du liquidus, TL, le liquide commence à cristalliser et le
volume diminue brutalement. Lorsqu'il n'y a plus de liquide, le solide continue
de se refroidir et le volume diminue encore, avec une pente p2 (avec p2 < p1).
Considérons maintenant le refroidissement d'un solide fondu conduisant à
un verre amorphe.
Au cours de la baisse de température, le volume diminue avec une pente p1.
Arrivé à une température, TG, inférieure à la température du liquidus (ou fusion)
et appelée température de transition vitreuse, le volume diminue
encore mais avec une pente plus faible p3 (p3 < p1; p3 ≈ p2). A partir de
ce point le liquide se comporte comme un solide sans qu'il y ait eu formation de cristaux. Le solide, du verre, est amorphe. C'est essentiellement la
viscosité élevée du liquide, qui empêche le mouvement nécessaire des atomes, pour qu'ils se répartissent suivant une structure cristalline ordonnée.