
cliquez sur la figure pour revenir à l'original
 cliquez sur la figure pour revenir
cliquez sur la figure pour revenirà l'original
Définir... La structure cristalline et la trempe des aciers
Les métaux et alliages ont une structure cristalline qui appartient à l'un des trois types suivants :
|
a)- cubique centré
|
 cliquez sur la figure pour revenir à l'original |
Exemples de métaux cliquez sur la figure pour revenir
cliquez sur la figure pour revenirà l'original |
Cette structure cristalline a bien entendu une incidence sur les propriétés du métal. Il est ainsi possible dans certains cas de
modifier la structure cristalline pour modifier certaines propriétés du métal. C'est le cas par exemple dans le phénomène de
trempe appliqué à l'acier, dans le but d'augmenter sa dureté.
La trempe est un traitement thermique qui consiste à porter un matériau, se trouvant sous une certaine forme cristalline α, à une
température où il va se produire un changement de forme cristalline pour donner une nouvelle phase β (en le laissant un temps
suffisant). Ensuite par un refroidissement rapide, en plongeant le matériau dans un fluide froid (eau, air, huile, ...) on pourra obtenir une
phase α' hors équilibre, possédant des propriétés physiques intéressantes, par exemple une plus grande dureté.
Prenons l'exemple d'un acier
(alliage de fer et de carbone avec une teneur en C < 2,2%; si la teneur en carbone est plus élevée, l'alliage est appelé
fonte)
contenant 0,45% de carbone (acier courant) :
A l'état stable, à température ambiante, l'acier est composé de cristaux de Fer (Fe) avec 0,022% de Carbone (C) en solution
solide (phase ferritique ou fer α), et de cristaux de carbure de fer
(Fe3C ; 6,67% de carbone) ou cémentite. Ce mélange à structure
lamellaire est appelé perlite. Les cristaux de ferrite ont une structure de type
cubique centrée.
|
Vous pouvez faire tourner la structure et zoomer A une température supérieure à 800 °C (900 / 920 °C par exemple), cet acier Dans la structure austénitique les espaces interstitiels sont plus grands que Exemple de maille de type austénite |
Le but de la trempe va donc être de passer rapidement de la structure austénitique chargée en carbone, à la structure ferritique
hors équilibre contenant un peu de carbone, alors que la forme stable n'en contient pas. La baisse très rapide de la température
ne laisse pas le temps au carbone de diffuser hors de la maille. Ces atomes de carbone enclavés vont engendrer des
contraintes dans les cristaux , ce qui augmente au final la dureté du métal. Mais à cause de ces contraintes, l'acier est aussi très
"cassant". Pour le travailler il est nécessaire de diminuer les contraintes mécaniques par un
revenu.
Ces étapes sont détaillées ci-dessous :
|
a)-
chauffage de la pièce en acier jusqu'à une température de 920 °C
pour être dans le domaine de la structure austénitique (point A). La pièce est maintenue un certain temps à cette température pour atteindre un équilibre. Des atomes de carbone diffusent dans les mailles cristallines du fer de structure cubique à faces centrées. Un atome de carbone peut se glisser au centre de la maille et/ou au centre de chaque arête du cube (figure A).
b)-
refroidissement rapide de la pièce en acier jusqu'à une température
inférieure à
c)-
revenu de la pièce en acier pour réduire les contraintes mécaniques
(point C). |
Diagramme de phase simplifié du binaire Fe-C dans la zone qui nous intéresse 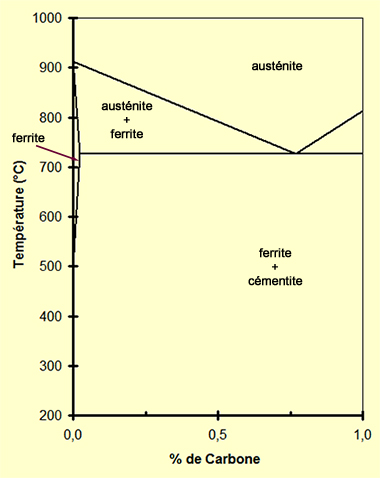 |