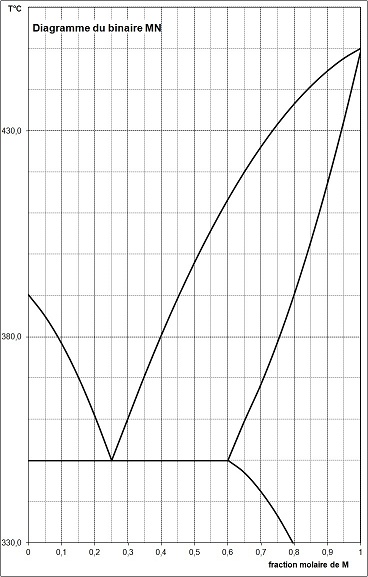
a- Donner sur le graphique le nom des
cinq zones :
- liquide,
- solide N + liquide,
- N solide + solution solide de N dans M,
- solution solide de N dans M,
- solide (MN) + liquide (MN).
b- La miscibilité de N dans M est partielle,
de 25 à 75 % c'est un diagramme à miscibilité partielle
et
celle de N dans N est nulle,
le diagramme de 0 à 25 % de M, est un diagramme de non miscibilité.
c- On refroidit un binaire MN jusqu’à 400°C et on obtient un mélange de liquide et de solide. Les tracés permettent d'obtenir la composition du solide et du liquide. La composition du solide (point 1) est de 84 % de M, la composition du liquide (point 2) est de 51 % de M.
La composition du binaire MN qui conduit à 20 % de liquide et 80 % de solide à une température de 400 °C (point 3) est de 78 % de M.
d- La température de fusion de l'eutectique (point 4) est de 350 °C et composition de l’eutectique est de 25 % de M.
f- La température à laquelle le binaire composé de
20 %
de M est entièrement solide (point 5) est de 350 °C, entièrement liquide (point 6) est de 360,5 °C.
Le premier grain de solide (point 7 = 6) est composé de N pur.
La composition de la dernière fraction de liquide (point 8) est de 25 % de M, c'est de l'eutectique.
e- On dispose de 120 g d’eutectique, la lecture sur le diagramme donne 25 %de M et 75 % de N dans celui-ci mais en molaire !