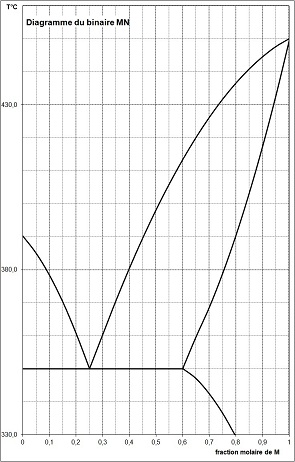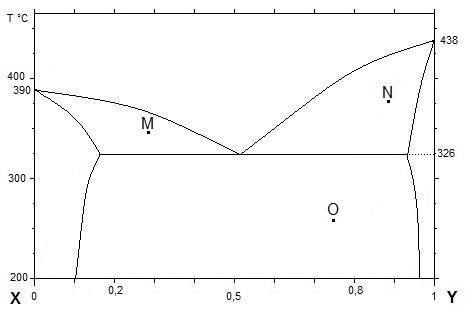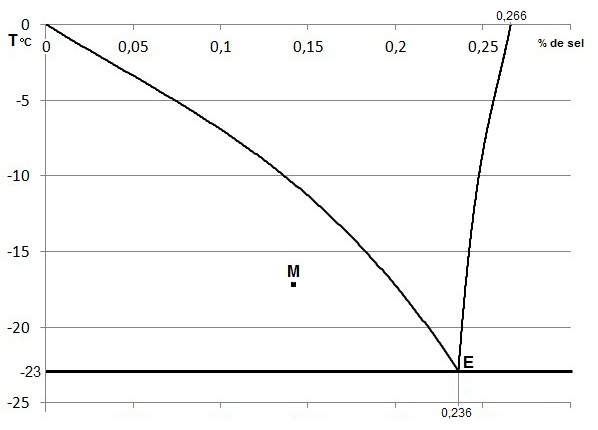
A partir du diagramme proposé qui concerne le mélange binaire glace / sel :
a- Commenter les valeurs indiquées sur le diagramme (point de fusion, point E, valeurs indiquées, ...).
b- Pour chaque zone, préciser la nature : solide, liquide et la composition.
c- Pour le point M donner les pourcentages et la nature des phases présentes à cette température.
d- Si l'on part d'un mélange de composition xM et qu'on le refroidit lentement de 0 °C à
-25 °C, décrire les états et la structure microscopique du solide obtenu.
e- Pour le point E donner les pourcentages
et la nature des phases présentes à cette température.