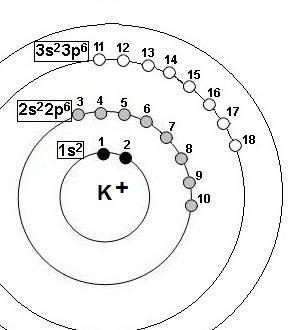
5-Énergie électronique totale de l'ion Potassium :
Etotale(K+) = Ee1 + Ee2 + ... + 2 Ee19 = 2Ee1 + 8Ee3 + 8 Ee11
Les règles de Slater permettent d'écrire :
Etotale(K) = 2Ee1 + 8Ee3 + 8Ee11
Trois valeurs de Z à calculer car il y a 3 groupes de Slater
Ze1 = 19 – (1x0,3) = 18,7
Ee1 = (18,72 / 12) x (-13,6) = - 4755,8 eV
Ze3 = 19 – (7x0,35) – (2x0,85) = 14,85 E3 =
(14,852 / 22) x (-13,6) = - 749,8 eV
Ze11 = 19 – (7x0,35) – (8x0,85) - (2x1) = 7,75 Ee11 = (7,72 / 32) x (-13,6) = - 89,6 eV
Etotale (K+) = (2 x - 4755,8) + (8 x - 749,8) + (8 x - 89,6)
Etotale (K+) = - 16226,8 eV donc I1 = (- 16226,8) - (- 16231,4) = 4,6 eV