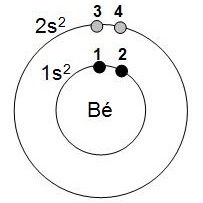
Energies d’ionisations de l’atome de Béryllium :
1- c'est le 4ème élément : Z = 4
2- structure électronique : 1s22s2 (voir classification)
3- groupes selon Slater : (1s2)(2s2)
4- dessin correspondant

5- Énergie électronique totale du Béryllium :
Etotale(Bé) = Ee1 + Ee2 + Ee3 +
Ee4 = 2 Ee1 +2 Ee3
Deux valeurs de Z à calculer car il y a 2 groupes de Slater (E0 = - 13,6 eV)
Ze1 = Z1 = Z2 = 4 – (1 x 0,3) = 3,7 Ze3 = Z3 = Z4 = 4 – (2 x 0,35) – (1 x 0,85) = 2,45
Ee1 = E1 = E2 = (3,72 / 12) x E0
= - 186,2 eV
Ee3 = E3 = E4 = (2,452 / 22)
x (- 13,6 eV) = - 20,4 eV
Etotale (Bé) = (2 x - 186,2 ) +
(2 x - 20,4) = - 413,2 eV
|
|
attention, la valeur de E'e3 est différente de Ee3 car le groupe d'électrons est différent (1 e̅ au lieu de 2) |
Pour calculer l'énergie électronique totale de l'ion Béryllium (Bé+), on reprend les étapes 4 et 5 puis on en déduit I1 :
4- dessin correspondant 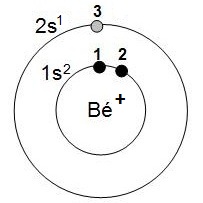 |
5- Énergie électronique totale de l'ion Béryllium (Bé+) : Etotale(Bé+) = Ee1 + Ee2 + Ee3 = 2 Ee1 + E'e3 Deux valeurs de Z à calculer car il y a 2 groupes de Slater Z1 = 4 – (1 x 0,3) = 3,7
Z'3 = 4 – (2 x 0,85) = 2,3 6- I1 = Etotale (Bé+) - Etotale (Bé) soit I1 = (- 390,4) - (- 413,2) = 22,8 eV |
![]() La valeur est éloignée de la valeur expérimentale car la théorie de Slater ne tient pas compte de
La valeur est éloignée de la valeur expérimentale car la théorie de Slater ne tient pas compte de
la stabilisation qu'apporte l'existence d'une couche complète.
4- dessin correspondant
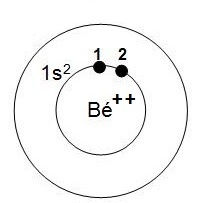
|
5- Énergie électronique totale de l'ion Béryllium (Bé++) : Etotale(Bé++) = Ee1 + Ee2 = 2 Ee1
Une seule valeur de Z à calculer car il y a 1 seul groupe de Slater 6- I2 = Etotale (Bé++) - Etotale (Bé+) soit I2 = (- 372,4) - (- 390,4) = 18,0 eV |
4- dessin correspondant
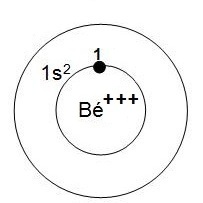
|
5- Énergie électronique totale de l'ion Béryllium (Bé+++) : Etotale(Bé+++) = E'e1 Une seule valeur de Z à calculer car il y a 1 seul groupe de Slater
Z'1 = 4 car il n'y a qu'un seul électron
E'1 = (42 / 12) x (- 13,6 eV) = - 217,6 eV 6- I3 = Etotale (Bé+++) - Etotale (Bé++) soit I3 = (- 217,6) - (- 372,4) = 154,8 eV |
12- Énergie électronique totale de l'ion Béryllium (Bé++++) est nulle car il ne possède aucun électron !
Etotale(Bé++++) = 0
13- I4 = Etotale (Bé++++) - Etotale (Bé+++)
soit I4 = 0 - (- 217,6) = 217,6 eV
|
|
Les valeurs sont proches des valeurs expérimentales, ce qui montre la validité de la théorie de Slater, |
Pensez à vérifier vos acquis et cochez les cases
![]() à la première page lorsque vous vous sentez capable de répondre à la requête proposée.
à la première page lorsque vous vous sentez capable de répondre à la requête proposée.