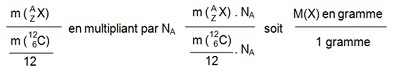
Définir ...
Unité de masse atomique
Définition
: L’unité de masse atomique est symbolisée par "u." et c’est par convention, le douzième
de la masse de
l’isotope le plus abondant du carbone (
1 u. = 1,66(05402).10-27 kg
Pour faciliter les calculs, on donnera les masses des atomes en u. aussi :
mproton = 1,00730* u. mneutron = 1,00866* u. mélectron = 0,00055* u.
*Attention, selon les références choisies, ces valeurs peuvent
différer légèrement mais cela ne change en rien les
savoirs faire présentés dans
ce cours.
Alors, la masse isotopique relative d’un atome est donnée par le rapport de la masse de l'atome
sur 1/12 de celle de
l'isotope 12 du carbone, soit :
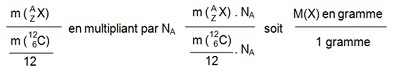
ce calcul conduit à un nombre abstrait qui représente la masse atomique relative si l’on prend une
mole de l’atome
considéré.
Attention, la masse atomique relative d’un élément naturel est la moyenne des masses isotopiques
relatives des
isotopes qu’il contient naturellement.
On lui attribue la valeur de la masse atomique en g.mol
Remarques :
- masse atomique (sens strict) = masse d’un atome 15,995 u. pour le
Utilisation de u.
L’énergie de liaison des nucléons dans le noyau peut être obtenue à partir de la relation d’Einstein qui est symbolisée par
Exemple : l’hélium 4 a une masse de 4,00260 u.
2 neutrons = 2 x 1,00866 u.
2 protons = 2 x 1,00727 u.
soit mparticules
= 4,03186 u.
Le défaut de masse Δm = 0,02926 u.
ΔE = Δm.c2 = 0,02926 x (10-3 kg /
6,022136.1023) x (2,99792458.108)2 / 1,602.10-19)
ΔE = 0,02926 . 931,5 MeV = 27,3 MeV
Cela signifie que lors de sa formation, un noyau d'hélium libère 27,3 MeV.
En général le résultat est proposé en MeV par nucléon sous forme d'une courbe appelée courbe d'Aston.
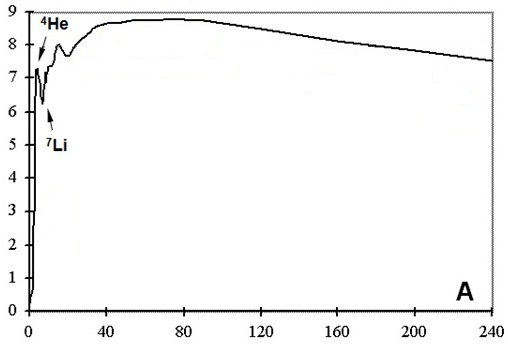
cliquer sur la figure pour
afficher toutes les informations
Les éléments dont les nombres de masse sont compris entre 40 et 60 sont plus
stables.
On comprend que la fission (casser les éléments les plus
lourds en éléments plus légers) ou la
fusion (fusionner les
éléments les plus
légers en éléments plus lourds), libère de l'énergie puisque
on obtient des éléments plus stables dans
les deux cas (plus de
détails sur cette courbe en suivant le cours).