Pouvoir polarisant et polarisabilité
Interactions entre dipôles
Lorsque deux dipôles sont au voisinage l’un de l’autre, ils sont en interaction.
Ceci est dû au fait qu'un dipôle crée un champ électrique et que le deuxième dipôle acquiert une
énergie
dans le champ
du premier dipôle.
L’énergie associée est fonction de la distance qui les sépare, de la valeur du moment dipolaire,
ainsi que de leur
orientation relative.
Il existe deux catégories de dipôle au niveau microscopique :
- les dipôles permanents, qui existent dans les molécules dites polaires
(OH2).
- les dipôles induits, qui existent pour toutes les molécules (le nuage électronique des molécules peut
se
déformer en présence d’un
champ électrique créant ainsi un dipôle
induit).
La déformation du nuage électronique est plus ou moins importante suivant la molécule dont il s’agit.
Cette aptitude est mesurée par une grandeur, appelée polarisabilité
et notée α. Plus la polarisabilité
est grande, plus le
nuage électronique se déforme facilement.
Dans un modèle très simpliste, nous retiendrons que pour que le champ électrique ait une forte
influence sur les électrons
de valence, il faut qu’ils soient peu retenus par les noyaux, c’est-à-dire
éloignés de ces noyaux. Or les électrons de valence
des atomes sont d’autant plus
éloignés des
noyaux
que l’atome est dans une période élevée de la classification
périodique.
Par exemple, dans la série des halogènes, le dichlore est peu polarisable, alors que le dibrome l’est
un
peu plus et que le
diiode est très polarisable.
Puisqu’il existe deux types différents de dipôles (permanent et
induit), il y a donc trois types d’interactions
possibles :
- l’interaction dipôle permanent-dipôle permanent,
- l’interaction dipôle permanent-dipôle induit,
- l’interaction dipôle induit-dipôle induit
que l'on détaillera par la suite.
Polarisabilité des atomes.
La polarisabilité est l’aptitude (ou la facilité) d’un élément apolaire à se polariser en présence d'un
champ (elle est
symbolisée par la lettre α).
La polarisabilité est l'effet de la déformation du nuage
électronique lorsqu'il est soumis à
l'influence d'un champ électrique extérieur.
Si un atome est petit le noyau est proche des électrons et le nuage électronique soumis à un champ
électrique se déforme
peu ou pas. Tandis que si l'atome est gros, un champ électrique pourra
déformer ce nuage dont les électrons externes
sont moins soumis à l'action du noyau positif, tant du
fait
d'une distance plus grande que de la présence d'électrons
internes en plus grand
nombre.
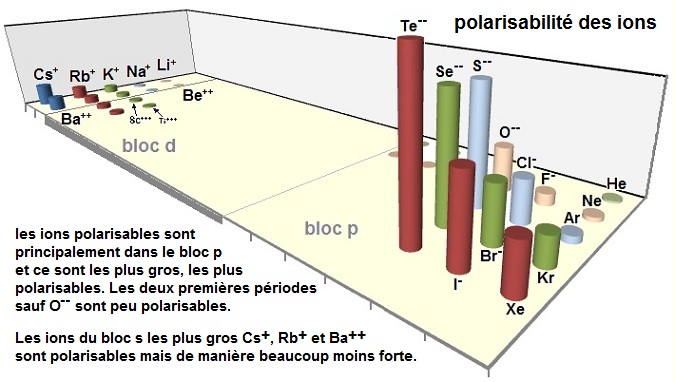
Polarisabilité des ions
La déformation d'un ion est d'autant plus forte que :
- le nombre d'ions de signe opposé qui l'entourent est petit (la polarisation
d'un ion en coordinance
4 est plus grande que
celle d'un ion en coordinance 8)
- la charge de l'ion est élevée et son rayon important (les anions seront donc très polarisables, plus
que l'atome
correspondant).
Un ion de faible rayon ionique et de forte charge est polarisant vis à vis des
ions de grand rayon
ionique et de faible
charge (ion polarisable)
Les gros cations sont polarisables par contre les petits cations sont très polarisants :
polarisables = Te-- (14 en
polarisabilité et 221 pm), Se--, S--, I-, Br-, Xe, O--, Cl-,
Pb++, Kr, Hg++, Cs+, Ag+,
Ba++,
Rb+,
Cd++, F- (1 en polarisabilité et 133 pm)
polarisants = C++++ (0,001 en
polarisabilité et 16 pm), B+++, Be++, Si++++, Li+, Al+++, Mg++, Na+,
Ti++++,
Zn++
(0,8 en polarisabilité et 74 pm)
