L'effet inductif
L’expérience montre que l’énergie et la longueur des liaisons varient peu d’une molécule à
l’autre.
Il est donc possible d’attacher à chaque type de liaison une longueur et une énergie (valeurs moyennes)
qui permettent de
donner une description correcte des molécules.
Il en est de même pour l’angle formé par les liaisons lorsque l’on a précisé son hybridation.
À cette invariance des propriétés des liaisons on apporte une correction par l’effet inductif.
Il est lié à la différence d’électronégativité des atomes.

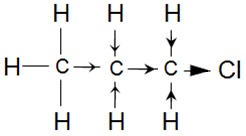
Par exemple, le chloropropane présente un effet inductif dû à
l’atome de chlore
que l'on peut illustrer avec
des flèches de taille
proportionnelle à l'effet.
Les deux électrons de la liaison σ sont distribués de manière
dissymétrique par rapport au milieu de la liaison
C-Cl.
L’effet inductif est une correction au modèle trop simple des
liaisons localisées indépendantes.
On peut classer les éléments en fonction de l’effet qu’ils induisent sur le
squelette hydrocarboné et l’on
se
réfère à
l’hydrogène auquel on attribue un
effet inducteur nul. Il y aura des groupements
électro-attracteurs qui ont des effets
donneurs notés "+
L'effet inductif peut modifier la réactivité des molécules ou des ions. Si un
atome d'un composé est
chargé positivement
du fait d'un effet inductif attracteur, il attirera les
composés chargés négativement
et réagira plus facilement avec eux
et réciproquement (ce sera des réactions
nucléophiles ou
électrophiles)
Les ions en chimie organique (molécules possédant une charge comme R+) peuvent être stabilisés
par
effet inductif
et faciliter des
réactions qui font intervenir ces ions instables.
Par exemple : R3C+ stabilisé
par l'effet inductif donneur de 3 groupements alkyl conduit à des
substitutions d'ordre 1
dites SN1
alors
que RCH2+ qui n'est pas suffisamment stabilisé par l'effet donneur d'un
seul alkyl conduit à des
substitutions d'ordre 2 dites SN2.
Atomistique et liaison chimique
La liaison chimique
Exercices
![]()
Pr Robert Valls
robert.valls@univ-amu.fr