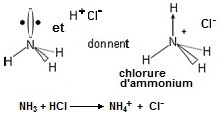
 • l'ion ammonium (NH
• l'ion ammonium (NH
Liaison de coordinance
Une liaison covalente de coordination (anciennement "liaison dative") est une description de la liaison
covalente entre
deux atomes pour lesquels les deux électrons partagés dans la liaison proviennent
du même atome.
La distinction par rapport à une liaison covalente ordinaire est artificielle, mais
c'est la terminologie
généralement adoptée
en particulier pour décrire les composés de coordination.
Néanmoins, sa force, sa description et ses propriétés ne sont pas différentes des autres
liaisons
polaires.
Les liaisons covalentes de coordination sont évoquées lorsqu'une
base de Lewis
(donneur
d'électrons)
fournit une paire
d'électrons à un acide de Lewis (accepteur d'électrons) afin de
donner
un adduit.
Le processus de formation d'une liaison dative est appelé coordination, d'où son
nom.
Le donneur d'électrons acquiert une charge positive, l'accepteur d'électrons acquérant dans le
même
temps une charge
formelle négative.
Exemples de liaisons de coordinance
De manière classique, tout composé contenant une paire d'électrons non appariés peut former une
liaison de
coordination. La liaison dans divers composés chimiques peut être décrite comme une
liaison covalente de coordination
(inter moléculaire NH3 ou intra
moléculaire CO) :
 • l'ion ammonium (NH
• l'ion ammonium (NH
 • le monoxyde de carbone (CO) peut être considéré comme présentant une liaison
• le monoxyde de carbone (CO) peut être considéré comme présentant une liaison
de coordination
et deux liaisons covalentes entre les atomes de carbone et d'oxygène.
Cette description très inhabituelle illustre la flexibilité de ce type de description.
Les liaisons de coordination sont très courantes dans les molécules du vivant ayant une partie
métallique : dans les
chélats , dans des molécules interagissant
avec l'ADN
(Zinc) ainsi que dans
tous
les composés à bases
de pyrrole telle
que l'hémoglobine, la myoglobine où le phytochrome
dont les
liaisons de coordination
sont fondamentales pour la
réalisation de leurs fonctions biologiques.
Remarque :
La notion de liaison de coordination est couramment utilisée pour décrire les
complexes
de
coordination, et
particulièrement ceux
impliquant des ions métalliques.
Dans de tels complexes,
plusieurs bases de Lewis donnent leurs
paires d'électrons "libres" à un
autre cation
métallique
dépourvu, qui agit comme un acide de Lewis et accepte donc les
électrons.
Des liaisons de coordination se forment et le composé
résultant est appelé "complexe de
coordination", et les
donneurs d'électrons sont appelés ligands.