Définir ...
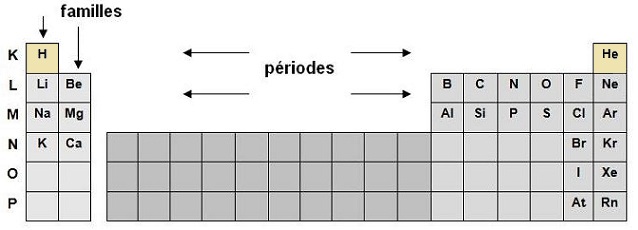
Lecture de la classification
Mendeleïev s’aperçoit qu’en disposant les éléments par poids atomique croissant, on observe une périodicité de leurs
propriétés. Il décide donc de rassembler dans une même famille les éléments possédant des propriétés voisines et définit
ainsi les bases de la classification actuelle.
Ainsi, les éléments ne sont plus classés par nombre de masse croissant mais par ordre de numéro atomique Z croissant.
Il existe plusieurs façons de présenter la
classification périodique (pensez à zoomer sur l'élément recherché la résolution est
maximale). Nous adopterons la présentation compacte ci-dessous.

Des lignes horizontales appelées périodes dans lesquelles les éléments sont disposés de gauche à droite selon l'ordre
croissant de leur numéro atomique Z.
Des colonnes verticales qui correspondent à des familles ou des groupes chimiques, les éléments définis par une
colonne possèdent une configuration électronique identique de leur couche externe.
Pour mémoriser les premières lignes de la
classification :
H et He
Lili Bêla Bien Chez Notre Oncle François-Nestor
Napoléon Mange Allègrement Six Poulets Sans Claquer d'Argent
Remarques :
- La lettre A ou B permet de mieux préciser les analogies chimiques entre les colonnes définies par le même chiffre
romain. Par exemple, les éléments de la colonne IA et IB ont des propriétés chimiques semblables (ion X+, …) de même
pour IIA et IIB (ion X2+, …).
- La colonne VIIIA a été rajoutée au moment de la découverte des gaz rares appelés aussi gaz inertes, seuls éléments
chimiques à exister dans les conditions normales, comme corps simples sous forme monoatomique.
- Les lanthanides (Z de 57 à 71) et les actinides (Z de 90 à 103) sont représentés sous le tableau afin d’en
limiter la
taille (la série des 14 lanthanides devrait être intercalée entre Lu et Hf).
On peut découper le tableau périodique en 4 blocs :
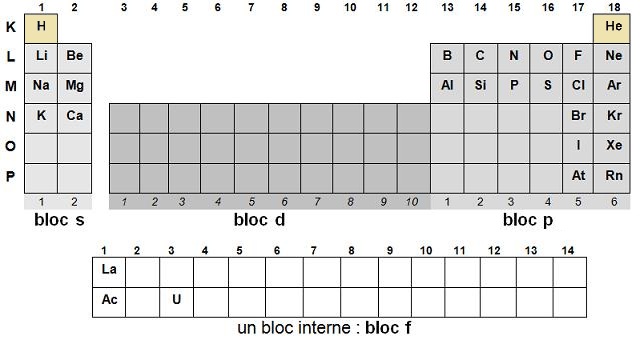
Avec la représentation suivante on peut lire le premier élément (1) en haut à gauche jusqu’au dernier (112) en bas à droite
par Z croissant.
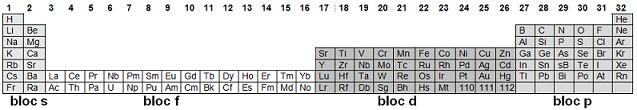
- Le bloc s
Le bloc s est constitué de métaux, il correspond aux colonnes 1 et 2 du tableau périodique, respectivement celle des
alcalins (cation de type M+) et des
alcalino-terreux (cation de type M2+).
- Le bloc p
Rassemble les colonnes 13 à 18. Le bloc p est constitué de métaux, de non métaux et d'éléments "tangents" ou
métalloïdes tels que l'arsenic ou le germanium.
La colonne 18 est celle des gaz rares qui sont très stables chimiquement.
La colonne 17, celle des halogènes, donne des anions monovalents (F-, Cl- …), très stables chimiquement (anions de
degré d'oxydation - 1).
La colonne 16 est celle des chalcogènes, les atomes de ces éléments donnent des anions divalents O2-,
S2- …
(anions de degré d'oxydation - 2).
- Le bloc d
C'est un bloc de métaux qui est de loin le plus complexe. La première ligne du bloc d, contient les deux premières
exceptions à la règle de Klechkowsky, le chrome (24Cr) et le cuivre (29 Cu).
- Le bloc f
Le lanthane devrait avoir la structure électronique [Xe] 4f15d06s2
mais c’est une exception à la règle de Klechkowsky et
sa structure est [Xe] 5d16s2. A ce titre, il a été le premier élément du bloc 5d mais comme il est l’élément 57
on peut
aussi le considérer comme le premier élément du bloc f.
Il aurait fallu imaginer une classification périodique avec, non pas 18 colonnes, mais 32 colonnes.
Généralement, on place le bloc f sous les trois blocs accolés s, p et d.
Les quatorze éléments qui suivent le lanthane sont appelés lanthanides ou "terres rares".
Sous les lanthanides il y a la famille des actinides. Au-delà de l'uranium (le dernier élément naturel) on aborde les
transuraniens, c'est à dire des éléments artificiels, élaborés à partir de 1945.