I- Isotopie. Le Cuivre naturel est composé de deux isotopes naturels qui sont le Cuivre 63 et le Cuivre 65 de masse
respective 62,930 et 64,928 g.mol-1.
Calculer le pourcentage relatif des isotopes dans la nature.
II- Les réactions nucléaires. Donner l’écriture complète des réactions nucléaires suivantes :
a- 92Aa +
1Bb → 146La + 87Cc + 3 neutronsb- 63Cu + 1Dd → 63Ee + 1 neutron (les doubles lettres en italique sont les inconnus)
c- L’Azote 14 interagit avec une particule α pour donner un élément à déterminer et un proton.
d- Le Polonium 218 est radioactif β- et α. Ecrire les deux réactions.
III- Nombres quantiques. Dessiner les cases quantiques du Titane (Z = 22).
a- Numéroter de 1 à 22 les électrons dans l’ordre de remplissage.
b- Donner les nombres quantiques du 20ème électron dans l’ordre de remplissage.
c- Préciser le nom et le rôle de chacun des nombres quantiques.
IV- Bohr, Rydberg et Balmer. Il s’agit de calculs rapides à mener à partir de vos connaissances sur
les formules
concernant l’atome d’Hydrogène.
a- Donner (sans calcul) la valeur de l’énergie et du rayon du premier niveau électronique de l’atomed’hydrogène et donner
le nom que l’on donne à ce niveau et sa symbolisation.
b- Calculer la valeur de l’énergie et du rayon du troisième niveau électronique de l’atome d’hydrogène et donner leur
symbolisation.
c- Calculer la longueur d’onde de la deuxième raie de Lyman puis de la première de Balmer à partir de ΔE = hν.
Donner leur symbolisation.
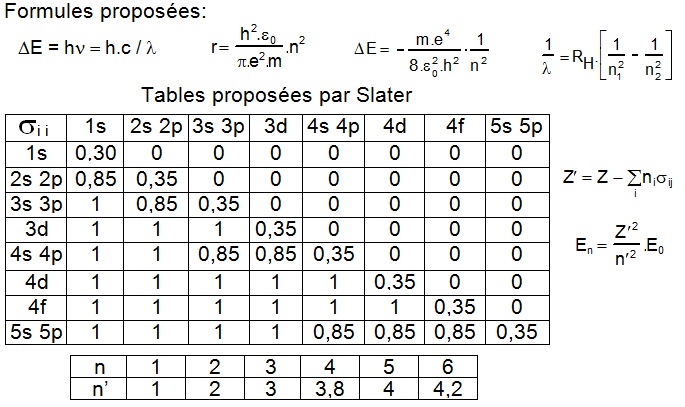
V- Approximation de Slater. Pour l’atome de Strontium (il est inutile de calculer l’énergie totale) :
a- Calculer les énergies de première et deuxième ionisation (par la méthode de Slater).
b- Calculer la longueur d’onde émise lorsque l’atome se forme à partir de l’ion Sr+.
c- Lorsque l’atome se forme à partir de l’ion Sr+, nommer la longueur d’onde (λx→y) et expliquer le phénomène électronique
qui se produit.
d- Calculer l’énergie électronique totale du Strontium (à garder pour la fin car les calculs sont longs).
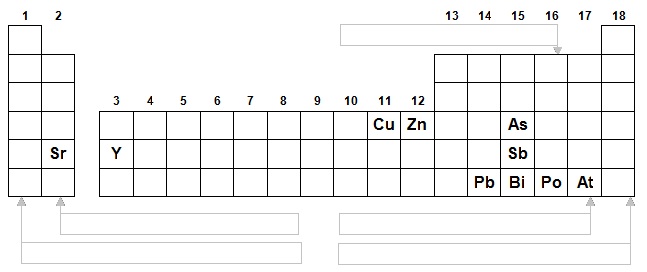
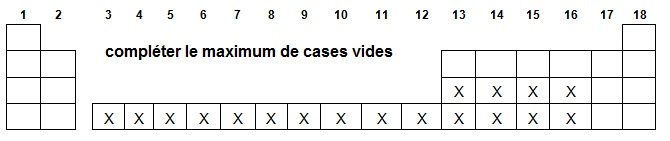
VI- La classification. Placer le plus possible d’éléments, utiliser les termes famille, période, bloc (hachurez les zones
correspondantes) et donner le nom des colonnes 1, 2, 16, 17 et 18 sur la classification ci-dessous et indiquer l’ion le plus
stable.

b- Inscrire les électronégativités (que vous connaissez) des éléments dans la case correspondante.
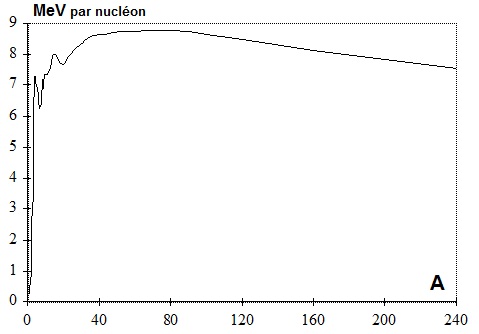
VII - Les énergies de cohésion des atomes. Situez sur le diagramme de variation des énergies de cohésion les
valeurs.
a- On donne la masse des particules et on demande l’énergie de cohésion (en MeV) par nucléon du noyau de Deutérium.
b- On donne l’énergie de cohésion par nucléon du noyau d’Hélium (7,23 MeV) et on demande de calculer la masse en
unités de masse atomique (u.) du noyau d’Hélium.
VIII - L’énergie nucléaire. On constate que l’Uranium 235 réagit avec un neutron pour donner de l’Yttrium 95, un élément
(Xx à déterminer) de nombre de masse égal à 139 et des neutrons.
a- Ecrire l’équation correspondant à cette réaction.
b- Calculer l’énergie libérée par la réaction en MeV (comparez aux 116 MeV mesurés expérimentalement).
NA = à connaître ! charge de l’électron =
à connaître ! RH = 10973731,53 en S. I.
1 u. = à connaître ! ou savoir calculer en S. I.
si Δm = 1 u. → ΔE = à connaître ! ou savoir calculer en S. I.
mp = 1,6732. 10-27
S. I. = 1,00727 u. mn = 1,6755.10-27
S. I. = 1,00866 u.
me = 9,109.10-31
S. I. = 0,00055 u.
h = 6,626.10-34
S. I. c = 3.10
8S. I.
M(2H) = 2,01360 u. M(235U) = 235,04392 u. M(139Xx) = 138,91536 u.
M(95Y) = 94,99545 u. M(87Br) = 86,99634 u.
En g.mol-1
: MH
= 1,008 MO
= 15,999 MNa
= 22,990 MS = 32,066
MCu = 63,540
On rappelle que La est le 57ème élément et U le 92ème.