.....................ÉNERGIE INTERNE - ENTHALPIE
Définir ... VARIATION DES ENTHALPIES AVEC LA TEMPERATURE
Loi de Hess : La chaleur de réaction à volume ou pression constante ne dépend ni du nombre
ni de la nature des étapes
intermédiaires.
Calcul d’enthalpies en fonction de la température (cycle à 4 étapes) :
cliquer sur la figure pour revenir à l'original
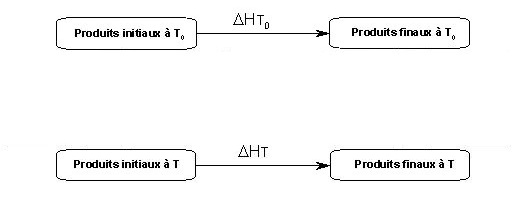
|
Pour aller des produits initiaux à T aux produits finaux à T, il y a
deux possibilités
(chemin rouge et chemin noir)
puisque
la loi de Hess nous apprend
que le chemin
suivi est indifférent et
il faut que toutes les
flèches correspondent à des
grandeurs du
même type (ici il s'agit
d'enthalpies ΔH).
Réchauffer
des composés à pression constante correspond à QP
et on sait que
QP = ΔH (voir les définitions de l'enthalpie). |
1°- la
flèche
correspondant à Σi Cpi.ΔT
est prise à contre-sens,
on attribue le signe négatif alors ΔHT = - Σi Cpi.ΔT + ...
2°- la
flèche correspondant à ΔHT0 est prise dans le même sens,
alors ΔHT =
- Σi Cpi.ΔT + ΔHT0 + ...
3°- la
flèche correspondant à Σf Cpf.ΔT
est prise dans le même sens,
alors ΔHT = - Σi Cpi.
ΔT + ΔHT0 + Σf Cpf.
ΔT
ou plus
simplement :
ΔHT = ΔHT0 +
(Σf Cpf - Σi Cpi).ΔT
On peut traduire cette expression en disant que l'enthalpie est augmentée de la quantité de chaleur
nécessaire pour
réchauffer les produits et diminuée de celle nécessaire pour réchauffer les
réactifs.
|
|
T |
|
|
Si Cp est une fonction de T, l'expression devient :
|
ΔHT = ΔHT0
+
ʃ |
(Cpf - Cpi)
dT |
|
|
T0
|
|
A retenir :
La loi de Hess et la relation entre l'enthalpie à T0 et l'enthalpie à T.
Thermodynamique et cinétique
Energie interne - Enthalpie
Exercices
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-amu.fr
