Chaleur et travail, énergie
Exemple : Etude d'un gaz parfait à pression constante
Un gaz parfait n'est pas visqueux, il ne dissipe donc pas d'énergie lors de ses transformations. C'est un modèle pratique pour exprimer les concepts de la thermodynamique.
Comme l'indique le premier principe, la variation d'énergie interne résulte d'une variation conjointe, ou non, de la variation de la quantité de chaleur et du travail mécanique que subit ou produit le système.
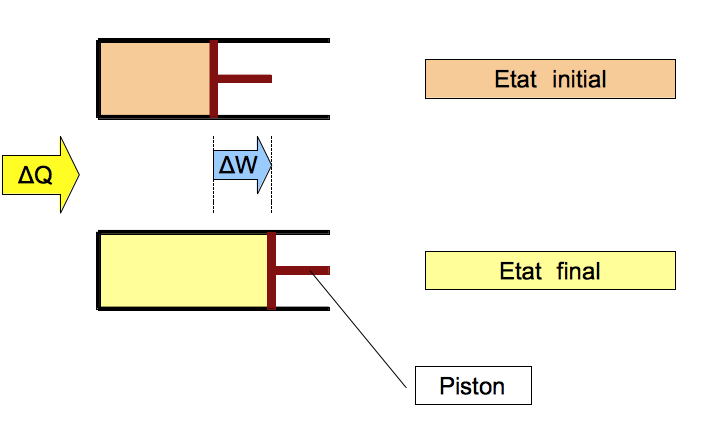
Le gaz à l'état initial possède des caractéristiques particulières de :
pression - pInitial
de volume - VInitial
de température - TInitial
A l'état final, le piston a changé de place, les caractéristiques du gaz sont maintenant :
pression - pFinal
de volume - VFinal
de température - TFinal
Le piston ne peut se déplacer que s'il reçoit un travail ; lequel est fourni par le gaz qui, sous l'effet de l'apport de chaleur, augmente de volume et pousse la piston de manière à ce que la pression soit équilibrée ; il s'agit d'un travail à pression constante laquelle est fixée par l'environnement extérieur.
Résultat :
pInitial = pFinal = pextérieure
VFinal > VInitial
Attention :
Cette petite expérience montre que la chaleur reçue par le gaz est convertible en travail, lequel ici permet de déplacer le piston.
Travail et chaleur sont donc de l'énergie et s'expriment en Joule.