THERMOCHIMIE
PREVISION DES REACTIONS
Second principe de la thermodynamique
Entropie
La chaleur est aussi une forme d'énergie. En 1854, le physicien Clausius a introduit une fonction mettant en jeu cette forme d'énergie: l'entropie (symbole S).
S est une fonction d'état. Sa variation est directement reliée à la chaleur échangée lors d'un processus thermodynamique.
Sous forme différentielle elle s'écrit: dS = dQ / T
A température constante, on a:
* D S = Q / T si le processus thermodynamique est parfaitement réversible (état d'équilibre pour une réaction chimique)
* D S > Q / T si le processus thermodynamique est irréversible
NB Il est bien connu que l'entropie d'un processus irréversible ne fait qu'augmenter.
Energie libre et Enthalpie libre
Tout changement spontané (donc non réversible) dans un système thermodynamique entraîne une augmentation de l'entropie. Celle ci atteindra sa valeur maximum lorsqu'un nouvel état d'équilibre stable est atteint. Corrélativement, l'énergie du système sera alors minimale. Ceci est en effet général: l'énergie minimale correspond à la stabilité du système.
On a alors introduit, pour étudier l'évolution des systèmes thermodynamiques deux nouvelles fonctions d'état comprenant un terme énergie et un terme entropique:
- Energie libre pour les systèmes évoluant à volume constant :
Enthalpie libre pour les systèmes évoluant à pression constante :
Application du second principe à la prévision de l'évolution d'un système thermodynamique
Système évoluant à volume constant et température constante
En différentiant la fonction F, on obtient:
dF = dU - T. dS (T = cte) soit:
D F = D U - T. D S ou encore, puisque l'on est à volume constant:
D F = Qv - T. D S
* Cas d'un système réversible
Pour une réaction chimique, c'est l'état d'équilibre (réaction équilibrée)
Dans ce cas: D S = Qv / T (cf. 3-1) et:
Un état d'équilibre est caractérisé par une variation d'énergie libre nulle.
* Cas d'un système irréversible évoluant dans un sens donné
Pour une réaction chimique, c'est la réaction spontanée évoluant dans un sens donné
Dans ce cas: D S > Qv / T (cf. 3-1) et: T. D S > Qv
Une évolution spontanée est caractérisée par une variation d'énergie libre négative.
Corrélativement, si l'on a:
l'évolution du système est impossible.
Système évoluant à pression constante et température constante
Par un raisonnement analogue et en remplaçant D F par D G, on obtient:
Un état d'équilibre est caractérisé par une variation d'enthalpie libre nulle.
Une évolution spontanée est caractérisée par une variation d'enthalpie libre
négative.
l'évolution du système est impossible.
Tableau résumé
|
Variation d'énergie libre (Volume constant) |
Variation d'enthalpie libre (Pression constante) |
Evolution du système |
|
D F = 0 |
D G = 0 |
Système en équilibre Réaction équilibrée |
D F < 0 |
D G < 0 |
Système évoluant spontanément dans le sens prévu Réaction spontanée dans le sens prévu |
D F > 0 |
D G > 0 |
Evolution impossible du système dans le sens prévu Réaction thermodynamiquement impossible dans le sens prévu |
Prévision du sens de l'évolution des réactions chimiques par utilisation des grandeurs thermodynamiques standards
L'utilisation des grandeurs thermodynamiques standards est généralement suffisante pour prévoir l'évolution des réactions chimiques pour des températures pas trop élevées. En effet, D H, D U et D S sont des grandeurs qui varient peu avec la température (quelques % pour une variation de quelques centaines de degrés). En première approximation, on peut donc considérer que celles ci restent proches de leurs valeurs standards D H°, D U° et D S°.
On ne considérera que l'évolution des réactions à pression constante (celles à volume constant étant la même en remplaçant D G par D F et D H par D U). On a donc: D GR # D H°R - T. D S°R
Réaction exothermique: D H°R < 0
On a deux cas possibles selon le signe de la variation d'entropie standard de la réaction:
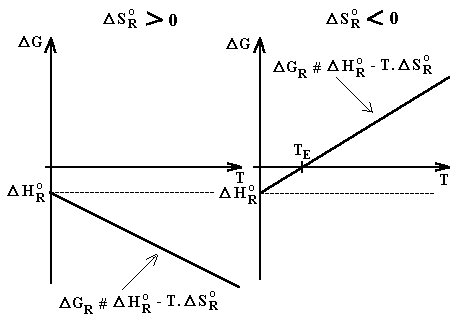
Lorsque D S°R > 0, le terme entropique T. D S°R est > 0, mais - T. D S°R est < 0. D G°R est alors constamment négative et la réaction est spontanée à toute température.
Lorsque D S°R < 0, le terme entropique T. D S°R est < 0, mais - T. D S°R est > 0. D G°R reste alors négative jusqu'à une température TE . La réaction est spontanée à basse température mais impossible à réaliser au delà de TE (température d'équilibre).
Réaction endothermique: D H°R > 0
On a également deux cas possibles selon le signe de la variation d'entropie standard de la réaction:
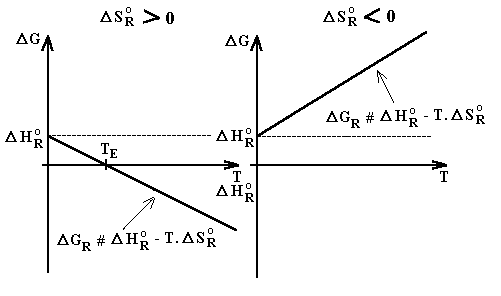
Lorsque D S°R > 0, le terme entropique T. D S°R est > 0, mais - T. D S°R est < 0. D G°R reste alors négative jusqu'à une température TE . La réaction est impossible à réaliser à basse température mais devient possible à réaliser au delà de TE (température d'équilibre).
Lorsque D S°R < 0, le terme entropique T. D S°R est < 0, mais - T. D S°R est > 0. D G°R est alors toujours positive et la réaction est impossible à réaliser quelle que soit la température.
NB Dans les tables de données thermodynamiques, on dispose des données nécessaires pour traiter la plupart des réactions chimiques. On peut donc prévoir si une réaction chimique donnée est réalisable ou non avant même de la réaliser.