Structure de l'atome
Classification périodique des éléments
Niveaux d'énergie permis
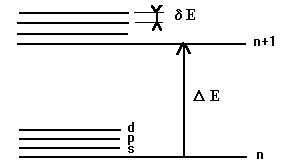
Contrairement à l'atome d'hydrogène ou l'énergie de l'électron ne dépend que du seul nombre quantique principal n, dans les atomes à plusieurs électrons cette énergie va maintenant dépendre à la fois de n et l (En, l ). On voit ainsi apparaître des niveaux (n) et sous-niveaux d'énergie (l). Ainsi, pour une même valeur de n, les énergies des électrons dans les états s, p, d, f, ... seront différentes.
Cependant, l'écart énergétique entre les sous-niveaux sera très faible par rapport à l'écart énergétique entre deux niveaux d'énergie successifs. d E < < D E (cf. figure ).

La résolution approchée montre que En, l augmente comme (n +l). Cependant, comme d E < < D E, En, l dépendra essentiellement de n.
|
Ainsi, les niveaux d'énergie permis pour un atome à plusieurs électrons seront classés par ordre croissant en fonction de (n +l) croissant. Cependant, lorsque deux valeurs de (n +l) seront identiques, c'est l'électron dont le nombre quantique principal n est le plus élevé qui aura la plus grande énergie. |
Exemple: Classer par ordre d'énergie croissante les électrons 3s et 2p
y 3s = y (3, 0) et y 2p = y (2, 1).
La somme (n +l) est identique pour les deux électrons et égale à 3: (3 + 0) pour 3s et (2 + 1)pour 2p. C'est donc la valeur de n qui va déterminer l'ordre des énergies soit: 3 > 2 ® E3s > E2p.