Classification périodique des éléments
Spectre de l'atome d'hydrogène
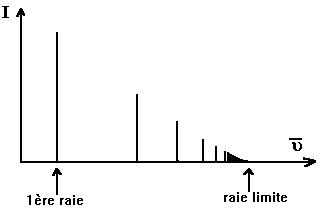
Aspect du spectre
Le spectre atomique de l'hydrogène s'étend de l'ultraviolet à l'infrarouge lointain. Il est extrêmement complexe car il comprend un très grand nombre de raies d'intensité très différente . Cependant, un examen attentif montre que toutes ces raies se regroupent en séries d'aspect analogue. L'aspect d'une série est montré ci-après

Les raies du spectre s'expliquent par les transitions qu'effectuent l'électron de l'atome d'hydrogène lors de son retour vers le niveau fondamental.
NB. Lors de sa parution, le modèle de Bohr a immédiatement connu un immense succès car il permettait d'expliquer le spectre atomique de l'hydrogène et de calculer les nombres d'onde des raies observées.
b-2) Calcul du nombre d'onde du rayonnement émis lors d'une transition énergétique entre 2 niveaux d'énergie
On considère le diagramme énergétique suivant:
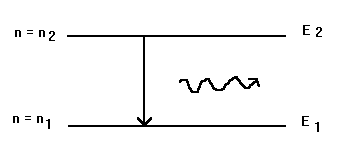
A la transition entre les deux niveaux d'énergie E2 et E1 (correspondant respectivement aux valeurs du nombre quantique n2 et n1) correspond l'émission d'un photon de fréquence n tel que n = D E/h = (E2 - E1)/h soit :
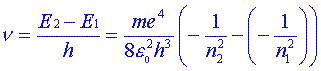
et sachant que ![]() = n /c = (E2 - E1)/hc , on obtient finalement:
= n /c = (E2 - E1)/hc , on obtient finalement:
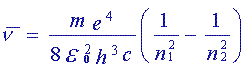
On trouve souvent cette relation sous la forme:
|
|
où 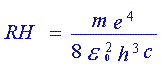 est appelé constante de Rydberg. Cette constante vaut 109670 cm-1.
est appelé constante de Rydberg. Cette constante vaut 109670 cm-1.
Dans la formule de Balmer, le niveau sur lequel revient l'électron (n1) caractérise la série et n2 correspond au niveau sur lequel se situe l'électron avant la transition (niveau de départ). On peut ainsi définir toutes les séries qui ont été observées:
- n1 = 1 n2 = 2, 3, 4,...........![]() série de Lyman (découverte en 1906)
série de Lyman (découverte en 1906)
- n1 = 2 n2 = 3, 4, 5,...........![]() série de Balmer (découverte en 1885)
série de Balmer (découverte en 1885)
- n1 = 3 n2 = 4, 5, 6,...........![]() série de Paschen (découverte en 1908)
série de Paschen (découverte en 1908)
- n1 = 4 n2 = 5, 6, 7,...........![]() série de Brackett (découverte en 1922)
série de Brackett (découverte en 1922)
- n1 = 5 n2 = 6, 7, 8,...........![]() série de Pfund (découverte en 1927)
série de Pfund (découverte en 1927)
Les transitions (n1 +1) ®
n1 , (n1 +2) ® n1
, (n1 +3) ® n1 ,....![]() ® n1 , correspondent respectivement aux
1ère, 2ème, 3ème raies.....et à la raie limite de chaque série. Cette raie limite
correspond à la plus grande transition énergétique que peut effectuer l'électron
(au delà, l'atome est ionisé: H+ , c'est pourquoi chaque série est
bornée vers les hautes valeurs de
® n1 , correspondent respectivement aux
1ère, 2ème, 3ème raies.....et à la raie limite de chaque série. Cette raie limite
correspond à la plus grande transition énergétique que peut effectuer l'électron
(au delà, l'atome est ionisé: H+ , c'est pourquoi chaque série est
bornée vers les hautes valeurs de ![]() ).
).
L'aspect du spectre de l'atome d'hydrogène s'explique alors aisément en se référant au diagramme d'énergie vu précédemment:
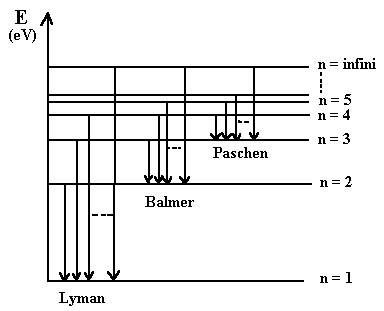
Sur ce diagramme sont représentées, pour les trois premières séries (Lyman Balmer, Paschen), les transitions énergétiques correspondant aux trois premiéres raies et celle correspondant à la raie limite de chaque série.