CINETIQUE CHIMIQUE
Cas particulier de la catalyse enzymatique
Objectif
Vous devrez être capable de comprendre et d'expliquer le mécanisme particulier de la catalyse enzymatique.
Mécanisme de la catalyse enzymatique
Rappel: Les enzymes sont des protéines à haut poids moléculaire (de l'ordre de 500000) dont l'action catalytique, extrêmement différenciée, se fait en certains points de l'enzyme appelés sites actifs.
Leur activité est très forte. Par exemple, la vitesse de décomposition de l'urée en présence d'uréase est augmntée par un facteur 1013.
Les réactifs constituent le substrat S d'une réaction biologique catalysée par une enzyme E qui conduit à des produits P.
Le substrat S réagit d'abord sur l'enzyme E pour donner un complexe enzyme-substrat qui conduit aux produits de réaction selon:
![]()
L'enzyme joue bien le rôle d'un catalyseur puisqu'elle est régénérée.
Modèle de Michaelis - Menten
Dès que le complexe E-S a commencé à se former, sa concentration se stabilise (puisqu'il peut redonner soit S + E ou P + E). Sa vitesse d'évolution devient nulle et on peut alors écrire:

soit :
K1 [ E] . [ S] = ( K'1 + K2 ) .[ E-S] et:
[ E] . [ S] / [ E-S] = ( K'1 + K2 ) / K1 = Km (constante de Michaelis)
La vitesse d'apparition des produits s'écrit alors: V = K2.[E-S] .
On peut estimer la concentration du complexe enzyme substrat [ E-S] à partir de la concentration du substrat [ S] et de la concentration initiale en enzyme [ E] 0 (concentration de l'enzyme introduite), soit:
Km . [ E-S] = [ E] . [ S] = ([ E] 0 -[ E-S] ) . [ S] soit:
[ E-S] . (Km + [ S] ) = [ E] 0 . [ S] et:
[ E-S] = [ E] 0 . [ S] / (Km + [ S] ).
Finalement, on obtient:
V = K2 . [ E] 0 . [ S] / (Km + [ S] )
En début de réaction, la vitesse de réaction est maximum car tous les sites actifs de l'enzyme sont occupés ([ E-S] = [ E] 0 ) et par conséquent on a: Vmax = K2 . [ E-S] = K2 .[ E] 0
Il est alors intéressant d'écrire la vitesse de formation des produits sous la forme:
V = Vmax . [ S] / (Km + [ S] )
On peut représenter V sous la forme du graphe ci après:
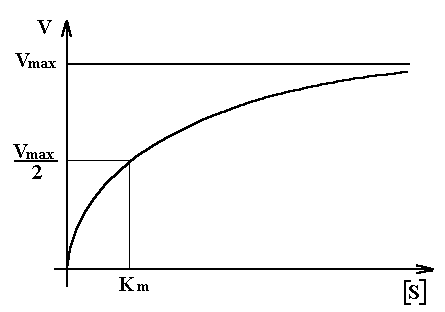
Cependant, avec un tel graphe, il est difficile d'évaluer avec précision la constante de Michaelis Km.
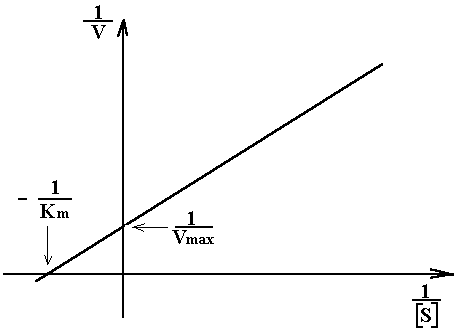
Lineweaver et Burk ont alors proposé une méthode plus précise de détermination graphique de Vmax et Km.
Pour cela, ils ont réécrit l'expression de la vitesse sous la forme:
(1 / V) = (1 / Vmax) + (Km / Vmax ) . 1 / [ S]
On porte ensuite sur un graphe 1 / V en fonction de 1 / [ S] pour obtenir Vmax et Km (cf. graphe ci après).
Test d'autoévaluation:
Définir tous les termes de la loi d'Arrhénius: K = A.e-EA/(R.T)
Physiquement, à quoi correspond EA ? Comment, expérimentalement, peut-on obtenir cette valeur?
Dans une réaction catalysée, à quel niveau intervient le catalyseur pour augmenter la vitesse de réaction? Que devient ce catalyseur?
Qu'est ce qui différencit la catalyse enzymatique de la catalyse d'une réaction chimique?
Que représente la constante de Michaelis? Comment l'obtient-on ?