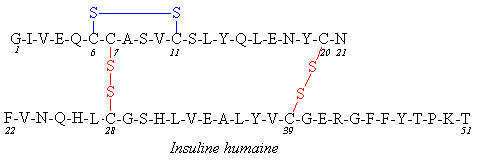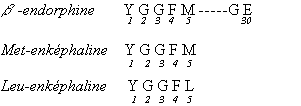Quelques Peptides d'interêt biologique
Nous avons vu qu’un certain nombre de peptides possédaient
des propriéts biologiques. Nous en citerons ici quelques uns, représentatifs
des différentes classes de peptides actifs soit :
-
par leur rôle physico-chimique (gluthation, aspartame)
-
par leur activité hormonale line,(insu glucagon, ocytocine, ACTH , etc….)
-
par leur rôle de neuropeptides (endorphines, enképhalines)
-
par leur fonction immunitaire (lymphokines, interleukines, interférons)
-
par leur rôle dans la réaction inflamatoire (les kinines)
-
par leur r rôle antibiotique (provenant de bactéries ou de champignons))
-
pa leur rôle toxique (champignons, venions etc…)
a – rôle physico-chimique
|
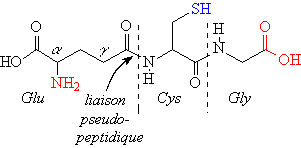
a1 : le glutathion : Glu-Cys-Gly
C’est un tripeptide qui possède un rôle important dans
les oxydoréductions cellulaires par la protection contre les aggressions
de l’oxygène et de ses formes actives (peroxydes et radicaux
libres) (voir ch 3 les lipides). Il possède la particularité de posséder
une liaison pseudo-peptidique (Glu lié par son g-COOH à la place de
l’a-COOH).
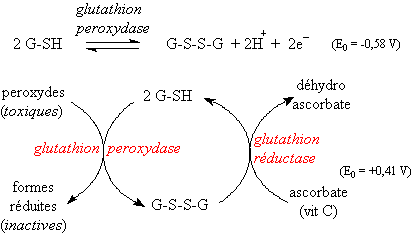
Il peut passer de l’état réduit (forme G-SH)
à l’état oxydé (G-S-S-G) en détruisant les peroxydes, grâce à
la glutathion péroxydase. Cette enzyme posséde une cystéine de son
site actif dont le S est remplacé par Se (selenium) la selenocystéine
(d’où le rôle joué par cet oligoélément en synergie avec d’autres
anti-oxydants). Le glutathion oxydé est régénéré par une glutathion
réductase en présence de vitamine C.
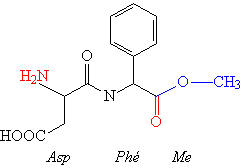
a2 : l’aspartame : Asp-Phe-Methyl ester
c’est un peptide de synthèse qui possède des
propriétés édulcorantes très puissantes (pouvoir sucrant élevé et
pas de pouvoir calorique car non métabolisé). C’est l’édulcorant
actuellement le plus utilisé. Il s’agit d’un dipeptide dont
l’AA Ct est estérifié par un Méthyl.
|
|
b – peptides hormonaux
De nombreuses hormones sont de nature peptidique tant au niveau
du sysrème digestif (pancrés) qu’au niveau de l’axe hypothalamus-hypophyse.
Ce sont soit des oligopeptides soit des polypeptides.
b1 : hormones pancréatiques
Nous citerons ici les 2 plus connues que nous reverrons par
la suite pour leur rôle dans la régulation du métabolisme énergétique. Il s’agit
de l’insuline et du Glucagon.
|
L’Insuline est un plolypeptide de 51 acides aminés qui est synthétisé
par le pancréas (cellules b des ilôts de Langherans, voir le cours
de physiologie). Il est constitué de 2 chaînes polypeptidiques de
21 et 30 résidus d’AA reliées par 2 ponts disulfures interchaines
(Cys 7-28 et Cys 20-39). Il existe un 3 è pont disulfure
intra-chaîne (Cys 6-20).
|
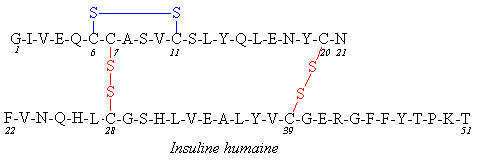
|
L’insuline de Bœuf ne diffère que par la nature de
l’AA n° 51 = Ala à la place de Thr. L’insuline Bovine est la première
structure polypeptidique connue, elle a été entièrement déterminée par voie
chimique par l’équipe de Sanger en 1955 (prix Nobel pour cela). C’est
l’hormone hypoglycémiante utilisée dans le traitement Diabètes Insulino
Dépendants (DID). L’insuline de Porc et de Bœuf ont longtemps été
utilisées en raison de leur structure très similaire (1 résidu différent entre
l’Homme et le Bœuf et 3 entre l’Homme et le Porc). L’insuline
humaine les a remplacé, maintenant produite par génie génétique.
Le Glucagon est aussi un polypptide synthétisé par le pancréas.
Il est constitué d’une seule chaîne polypeptidique de 29 résidus d’acides
aminés. Il possède la même séquence dans les différentes espèces de mammifères.Il
a une action antagoniste à celle de l’insuline (hormone hyperglycémiante)
que nous reverrons dans la régulation du métabolisme.
La Secrétine hormone polypeptidique de 27 AA , synthétisée par
le Duodenum et qui stimule le pancréas lors de la digestion (à l’origine
du mot " hormone " qui veut dire exciter en grec).
b2 : hormones de l’hypothalamus
|
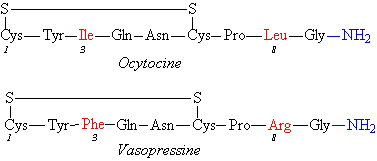
Nous verrons essentiellement 2 peptides de 9 résidus d’acides
aminés de structure similaire l’Ocytocine (premier peptide actif
a avoir été synthétisé chimiquemen) et la Vasopressine dont la structure
est décrite p .
|
|
Ils ne diffèrent que par la nature des acides aminés 3 et 8.
La fonction COOH terminale est bloquée par une fonction amide (résistance aux
peptidases). Ils possèdent cependant des fonctions différentes : l’ocytocine
déclenche les contractions des muscles lisses ( par exemple l’utérus pendant
l’accouchement). La vasopressine (ou ADH) est l’hormone antidiurétique
et agit au niveau des reins en régulant la sortie de l’eau.
b3 : hormone de l’hypophyse
|
Nous ne citerons qu’une hormone parmi les nombreuses secrétées
par le lobe antérieur de l’hypophyse. l’ACTH (Adrenocorticotropic
Hormon). C’est un polypeptide constitué d’une seule chaîne
de 39 résidus d’acides aminés. Il joue un rôle primordial dans
la régulation des flux de l’eau et du Na+ (système
Rénine-Angiotensine-ACTH dans la régulation de la pression sanguine).
Seuls les 24 premiers résidus sont communs dans les différentes espèces
animales et utiles à la fonction régulatrice (d’où l’utilisation
de peptides de synthèse ne contenant que ces 24 résidus).
|

|
c - les neuropeptides
|
De nombreux peptides sont impliqués dans le fonctionnement du cerveau
et notament au niveau de la douleur (mais aussi dans la physiologie
du goût). Ils se fixent sur les mêmes récepteurs cérébraux que la
morphine mais sont beaucoup plus actifs. On les a d’abord baptisés
endorphines (" endogeneous morphins ").
|
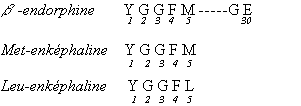
|
Puis ensuite on a isolé d’autres peptides actifs tels
que les enképhalines. Tous ces peptides de taille différentes débutent par la
même séquence de 5 résidus d’AA car ils proviennent du détachement d’une
protéine précurseur (dans la Leu-enképhaline un résidu de Leu remplace la Met
en C-terminal).
d – les peptides de l’inflammation
La réaction inflammatoire, en réaction à une aggression, est
due à l’action vasodilatatrice de molécules dérivés d’acides aminés
(Histamine et Sérotonine déjà vues p ) et de peptides les kinines. Elle sert
à augmenter le flux sanguin et la perméabilité des vaisseaux pour amener les
protéines et les leucocytes à l’endroit de l’aggression.
Les kinines sont une famille de peptides dérivés comme dans
le cas précédent, d’un précurseur le kininogène. Par exemple la Bradikinine,
un nonapeptide vasodilatateur, possède un analogue structural un décapeptide
(Glycyl-Bradikinine) qui se trouve dans le venin de guêpe expliquant ainsi la
grande réaction inflammatoire provoquée par les piqures.
Les interleukines et les lymphokines sont aussi des médiateurs
de l’inflammation, ils sont de nature peptidique, mais leur taille les
classe à la limite des polypeptides et des protéines (80 à 150 résidus d’AA)
e – les peptides antibiotiques
Ils sont synthétisés soit par des microrganismes (bactéries
ou moisissures). Ils contiennent des D-aminoacides etune structure cyclique
(qui semble indispensable au pouvoir antibiotique)
On verra en exemple 2 antibiotiques bactériens connus :
la Gramicidine et la Bacitracine et un antibiotique fongique : la pénicilline.
Ces peptides ont en commun d’être résistants aux protéases :
les extrémités N et C-terminales sont bloquées (peptides cycliques, acides aminés
atypiques)
|
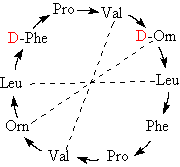
La Gramicidine S contient 2 Acides Aminés de la série
D et l’ornithine (AA du cycle de l’urée mais non présents
dans les peptides).
Ce peptide antibiotique appartient à la familles des
Tyrocydines (décapeptides cycliques synthétisés par les souches de
Bacillus). On remarquera la symétrie de position des acides aminés
(Orn = ornithine).
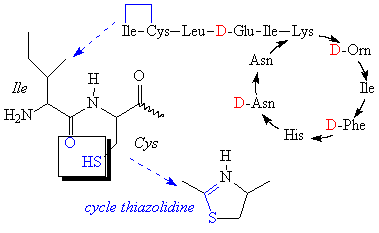
La Bacitracine A est un dodécapeptide possédant une
partie cyclique et une chaîne linéaire mais protégée à son extrémité
N-terminale par un cycle spécial (thiazolidine réalisé entre le thiol
de la Cys -2 et le carbonyle de Ile-1).
Les 2 extrémités du peptide sont ainsi protégées.
Cet antibiotique est aussi fabriqué par un bacillus.
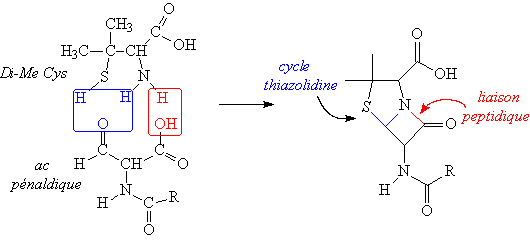
La pénicilline est produite par le Pénicillium.
Cet antibiotique à large spectre est un dipeptide
spécial renfermant 2 acides aminés atypiques, la DiméthylCystéine
et l’acide pénaldique (acide aminé aldéhyde) lié par 2 liaisons
faisant deux cycles accolés : une liaison peptidique et un cucle
thiazolidine (comme dans la bacitracine).
|
|
Cette molécule est aussi très résistante aux protéases. La
chaîne latérale dépend de la souche de pénicillium.
Enfin il existe encore bien d’autres peptides posédant
des activités biologiques, comme les cyclosporines , peptides cycliques renfermant
de nombreux acides aminés atypiques (synthétisées par des champignons) qui ont
des propriétés immunomodulatrices, très utilisés pour les transplantations d’organes
et pour traiter des maladies autoimmunes.