|
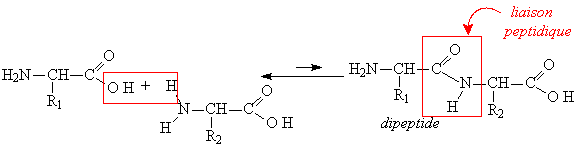
Nous avons vu (& 5.2.5. a3, p.18) que la liaison peptidique est de type amide substituée. Cependant la synthèse est difficile et l’équilibre est en faveur de l’hydrolyse |
 |
Liaison peptidique et chaine peptidique
|
Nous avons vu (& 5.2.5. a3, p.18) que la liaison peptidique est de type amide substituée. Cependant la synthèse est difficile et l’équilibre est en faveur de l’hydrolyse |
 |
La synthèse n’est possible qu’en milieu anhydre et après activation de la fonction acide (Chlorure d’acide). La biosynthèse des protéines se fera aussi par l’intermédiaire d’une forme activée (avec une liaison riche en énergie en utilisant l’ATP). (voir la biosynthèse des protéines en Biologie moléculaire).
Cependant la liaison peptidique est très résistante à l’hydrolyse (acides ou bases concentrées). Sa stabilité est due à la mésomérie de la liaison.
a - Conformation spatiale de la liaison peptidique
a1 - elle est polaire et plane
|
La liaison peptidique, en raison de la possibilité de faire un hybride de résonnance, est plane (voir mésomérie en chimie organique). La structure © est la plus probable. |
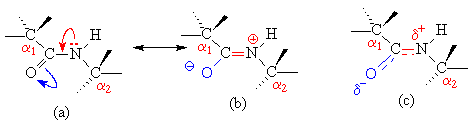 |
C’est une structure intermédiaire entre les 2 formes mésomères limites (on parle d’hybride de résonnance). La liaison possède 40% de la distribution électronique d’un e liaison double :
elle posède donc une structure rigide (peu de rotation libre autour de la laison C-N).
La liaison peptidique est aussi polaire puisque dans ces conditions Od- et Nd+.
La liaison est plane , on trouve les 6 atomes dans le même plan et il y a possibilité d’isomèrie cis/trans. Dans la forme trans, les 2 Ca de 2 résidus d’AA voisins sont le plus loin possible, c’est la forme la plus stable (répulsion stérique minimale).
La liaison peptidique sera donc presque toujours sous la forme trans, à l’exception du groupe imine de la Pro pour lequel les configurations cis et trans ont à peu près les mêmes énergies . Les configurations cis de la Pro provoqueront un coude dans la chaîne peptidique qui provoquera le repliement de la chaîne des protéines globulaires.
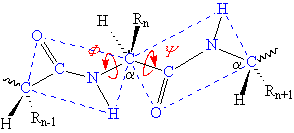
a2 - la rotation est possible autour des liaisons N-Ca et Ca-C
|
Les 2 plaques que constituent les 2 liaisons peptidiques s’articulent autour du Ca. Les angles de rotation possibles s’appellent F et Y. Leur liberté de rotation est limitée par les rayons de van der Waals. La nature de la chaîne latérale influe aussi sur la valeur de F et Y (grande importance dans la conformation spatiale des protéines). Puisque la rotation de la liaison peptidique n’existe pas, la conformation des peptides (et des protéines) est essentiellement due aux rotations autour des liaisons N-Ca (angle f) et Ca-C (angle y). |
|
L’ordre des acides aminés, dans une chaîne peptidique, est déterminé par le génôme. De cette séquence vont découler les propriétés physicochimiques et biologiques des peptides (ainsi que des protéines).
La séquence sera visualisée par des conventions d’écriture et de nomenclature éliminant toute ambiguité :
les 2 acides aminés qui se trouvent aux 2 extrémités de la chaîne peptidique s’appellent N-terminal (pour celui qui possède sa fonction a-NH2 libre) et C-terminal (pour celui qui possède sa fonction a-COOH libre).
par convention l’AA en position N-terminal sera placé à gauche et l’AA en position C-terminale à droite.
on écrit l’enchaînement des acides aminés de gauche à droite, en les numérotant à partir de l’extrémité N-terminale
les acides aminés liés par des liaisons peptidiques ont perdu une molécule d’eau sont appelés résidus. On ajoutera un suffixe yl sauf à celui en position C-terminale. On utilise généralement les 3 premières lettres (si la chaîne est trop longue on utilisera le code à une lettre).
Lorsque la connaissance de la séquence est incomplète, les acides aminés dont la position n’est pas connue sont écrits entre parenthèse : Gly-Ala-Asp-(Leu, His, Ile, Val)-Glu-Phé).
S’il s’agit d’un peptide cyclique (bactéries), la liaison peptidique sera visualisée par une flèche (sens -CO-NH-)
|
Ici on a représenté un nonapeptide possédant un pont disulfure entre la cystéine n°1 (AA N-terminal) et la Cystéine n°6. Ce peptide est de nature hormonale, il s’agit de la vasopressine (ou ADH = Anti Diuretic Hormon). On peut le représenter plus facilement de la manière
schématique suivante :
|
|
Son nom est alors :
Cystéinyl-Tyrosyl-Phénylalanyl-Glutaminyl-Asparaginyl-Cystéinyl-Prolyl-Arginyl-Glycinamide, car l’acide aminé en position C-terminal : la Glycine possede sa fonction carboxylique bloquée sous forme d’amide (glycinamide).
b2 : détermination de la séquence des peptides
Le principe général de la détermination de la séquence d’un peptide est similaire à celui de la détermination de la séquence des protéines (structure primaire) et sera détaillé dans le paragraphe correspondant (& ) :
isolement et purification du peptide
détermination de la masse moléculaire
hydrolyse et détermination de la composition en acides aminés
identification des acides aminés N et C-terminaux
établissement de la séquence par combinaison des méthodes récurentes (Edman ou enzymatiques)
hydrolyse éventuelle par des endopeptidases (pour les oligopeptides) permettant d’obtenir des oligopeptides plus petits. Dans ces conditions il faut recommencer tout le protocole pour chacun des fragments obtenus (isolement, composition en AA, N et C-terminaux, dégradation récurente etc…)