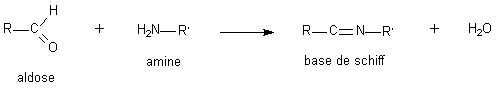Les oses (monosaccharides)
Propriétés chimiques
Dues à la fonction carbonylée
Comme nous l'avons, déjà vu les aldéhydes vrais donnent des acétals avec 2 molécules d'alcool, par contre les oses donnent des osides: par ex. l'a-D-Glc forme un peudo-éther entre l'-OH hémiacétalique et un CH3OH pour donner un Méthyl-glucoside . Cette liaison osidique est très importante, selon la position de l'-OH hémiacétalique on obtient un oside a ou b.
remarque: quand il s'agit d'un oside: le pont oxydique ne s'ouvre
plus (le cycle est stabilisé dans l'eau), la mutarotation n'est plus possible.
Cette réaction est à la base de la formation des saccharides.
Elle peut se faire entre 2 oses :
Entre l'hémiacétal et une fonction alcool d'un autre ose
:
On obtient un dissaccharide, par ex : Glc lié en a1-4 à du Gal est encore réducteur
(Gal possède encore son groupement terminal réducteur libre il peut donc réagir
soit sous forme linéaire, soit cyclisée)

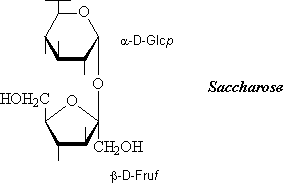
Entre les 2 groupements réducteurs des 2 oses :
On obtient un dissaccharide non réducteur par ex. entre l'hémiacétal en a C-1 du Glc et l'hémiacétal en b C-2 du Fru:
Les osides sont hydrolysables:
-Par voie chimique, à 100°C en milieu acide ([H+3O] = 1 à 4
M), pour redonner des oses
-Par voie enzymatique, à l'aide d'enzymes spécifiques : Les glycosidases, qui
reconnaissent l'ose en fonction de la nature de l'anomérie de la liaison osidique
(il existe par ex. des a et des b galactosidases, seule la 1ère est active sur
l'ex plus haut du Glc(a1-4)Gal.
La formation des osides est à la base des chaînes oligo et polysaccharidiques.