Les substances ioniques et les molécules polaires
sont solubles dans l'eau
Grâce à sa polarité, l'eau est attirée rapidement par les espèces ioniques et les autres substances polaires.
Cette interaction diminue les effets électrostatiques entre les ions ou les molécules d'une substance.
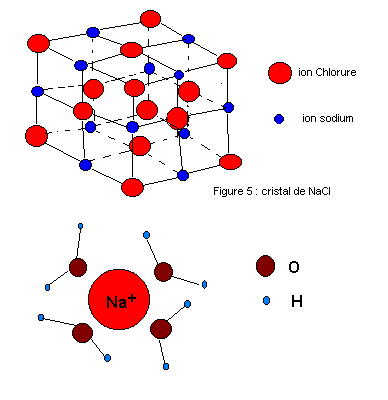
Par ex. quand on dissout un sel cristallisé comme le NaCl:
le réseau cristallin se disloque, car de très nombreuses molécules d'eau (dipôles) entrent en compétition avec de rares Na+ ou Cl-, les charges électriques des 2 ions sont plus faibles que dans le cristal.
L'ion Na+ attire le pôle - de O. Le Cl- attire le pôle + de H.
Les cations, en général plus petits, attirent plus de molécules d'eau (les noyaux sont plus près) que les anions.

La gaine de molécules d'eau enrobant chaque ion s'appelle la sphère d'hydratation. toute molécule (ou ion) entourée de solvant est "solvatée", on dit "hydratée" quand c'est par l'eau. Ce mécanisme est très important pour la solubilité des composés, car l'eau est l'unique solvant de la cellule.
Dans l'eau, cette solubilité dépend de leur polarité et de leur capacité à former des liaisons H avec l'eau.
Les molécules organiques non ionisées, mais portant des groupements polaires (alcools à courte chaîne comme les sucres: même explication que pour la fig 2.) sont très solubles dans l'eau, car leur groupement fonctionnel polaire forme des liaisons H avec les molécules d'eau voisines.
Ce sont des substances hydrophiles. Le mécanisme est le même pour les substances ionisables.