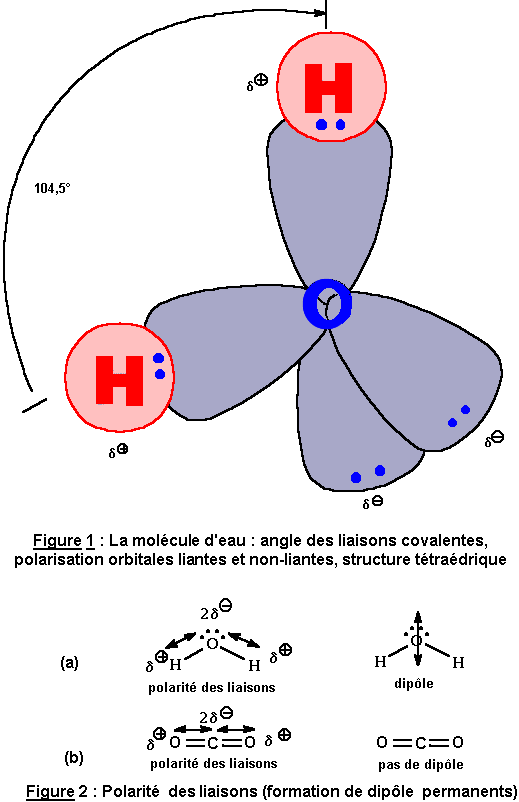
|
Molécule non linéaire, mais en forme de V (1): l'angle des 2 liaisons covalentes -OH est de 104,5°. 2 orbitales de l'atome d'oxygène participent aux liaisons covalentes avec 2 atomes d'hydrogène. Les 2 autres orbitales portent un doublet d'électrons non-liants.
Elle forme aussi un tétraèdre (comme le Carbone): Les liaisons possibles de l'eau avec des atomes interactifs voisins se feront aux sommets du tétraèdre. O est plus électronégatif que H: Dans (O-H), il attire plus les electrons. La fig 2 montre une distribution asymétrique des charges (d- sur O et d+ sur H). La liaison est qualifiée de polaire. Le déséquilibre de la répartition des charges sur la liaison s'appelle un dipôle. La polarité dépend aussi de la géométrie de la molécule. Remarque. O = C = O est colinéaire, elle ne présente pas de dissymétrie et n'est donc pas polaire. |
|