| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Devoir 2 : chimie inorganique descriptive
Correction du devoir 2 : Exercice 1 - Question e ...
1- Etude des familles d'éléments : le bloc s
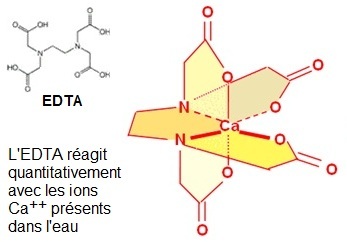
d- On propose la représentation d'un complexes formés avec les ions du bloc s, commenter la structure du complexe obtenu à partir de l'ion calcium et de
l'EDTA. Préciser les particularités de la structure de l'EDTA qui vont permettre la formation de ce complexe.
e- Cette structure est très stable et permet un dosage quantitatif des ions calcium, expliquer cette grande stabilité.
|
d- Les ions du bloc s sont trop gros pour former facilement des complexes simples stables mais ils peuvent donner des chélates avec les molécules dites chélatantes comme ici l'EDTA ou acide Ethylène Diamine TétrAcétique. Il faut se souvenir qu'un complexe est un édifice polyatomique constitué d'un cations entouré de plusieurs ligands qui sont des molécules (ou des ions) qui délocalisent une partie de leur densité électronique sur le cation, formant ainsi des liaisons chimiques avec celui-ci. Mais pour les chélates, le nombre de liaisons métal-ligand est au moins de 2 et on dit que les molécules chélatantes sont bidendates (ou polydendates). |
Le chélate se distingue donc du complexe simple (avec des ligands monodendates) par le fait que le cation métallique est fixé au chélateur par au moins deux liaisons de coordination et que de plus un ou des cycles à 5 ou 6 chaînons se créent, le chélateur agit alors comme une pince, d'où son nom.
e- La stabilité du chélate est assurée ici par l'apport électronique (par des doublets) des atomes d'oxygène et des atones d'azote à un
cation central (ici Ca2+) expliqué par la théorie du champ cristallin octaédrique. Le cation est entouré d'un ligand hexadendate qui
l'enveloppe et comme il existe
des possibilités de
cycles à 5 chaînons, toutes les conditions sont présentes dans ce ligand pour obtenir un chélate très stable.
La stabilité est si grande qu'il est possible de doser quantitativement les ions calcium présents dans l'eau.
| Pr Robert Valls | robert.valls@univ-amu.fr |