| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RELATION STRUCTURE-PROPRIÉTÉS
Connaissances ... définir ... les propriétés des céramiques ...
Les céramiques traditionnelles, destinées aux créations artisanales ou artistiques, sont connues depuis l'Antiquité.
Ce n'est que récemment que l'industrie s'est intéressée aux céramiques pour créer des matériaux aux propriétés physiques spécifiques :
mécaniques, électriques, magnétiques, optiques, piézoélectriques, ferroélectriques, supraconductrices ...
Ces céramiques, dites techniques, peuvent être classées en trois catégories en fonction de leur composition :
• les oxydes métalliques : Al2O3, BeO, Fe3O4, SiO2, ZrO2 ...
• les non-oxydes : carbures (SiC, W2C, TaC ...), borures (CaB6, HfB2, TiB2 ...), nitrures (AlN, BN, TaN...), siliciures (MoSi2, TiSi2, WSi2, ...)
• composites d'oxydes et non-oxydes : si de nombreuses céramiques sont composées uniquement de deux éléments, d'autres comprennent trois ou quatre éléments ou plus comme le carbure de tungstène-cobalt (WC-Co), le cuprate de lanthane-strontium (LaSrCuO) ...
Dans les céramiques, les liaisons sont de type ionocovalente.
Dans une liaison ionique, les électrons restent attachés à l'ion négatif.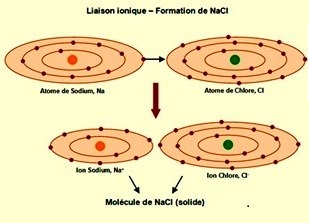
|
Dans une liaison covalente les électrons sont partagés entre les deux atomes.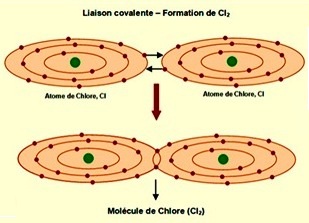 |
Pour une liaison ionocovalente, les électrons sont partagés dans les liaisons. 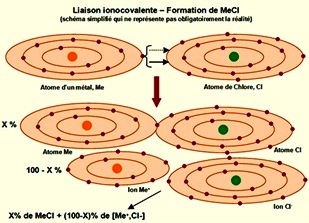
|
Dans la liaison ionocovalente, les électrons sont partagés dans les liaisons mais la probabilité de les rencontrer préférentiellement prés
de l'un des atomes est plus élevée.
La proportion de liaisons ioniques et de liaisons covalentes dépend de la différence d'électronégativité entre les éléments constitutifs.
Plus cette différence est grande, plus le caractère ionique est important.
Par exemple :
• la fluorite, CaF2, est ionique à 89% (EN : Ca = 1; F = 3,98 ; ΔEN = 2,98)
• alors que le carbure de silicium, SiC, n'est ionique qu'à 12% (EN : Si = 1,9 ; C = 2,55 ; ΔEN = 0,65)
Le caractère ionocovalent des liaisons conduit à des structures cristallines de géométrie compacte.
Les propriétés physiques spécifiques des céramiques, liées à leur structure, sont nombreuses, en particulier, les propriétés magnétiques et
thermiques sont à l'origine de nombreuses applications.
Les céramiques ayant des propriétés magnétiques intéressantes sont formées d'oxydes.
Elles sont appelées ferrites (Attention ! rien à voir avec la phase α du fer).
La plus anciennement connue est la magnétite, Fe3O4.
Les cristaux de magnétite contiennent deux formes différentes du fer, des ions Fe2+ et des ions Fe3+,
en fait la formule brute s'écrit :
(Fe2+)(Fe3+)2(O2-)4.
La structure cristalline de la magnétite, de type spinelle (voir sur "iutenligne"
la ressource Chimie du solide et matériaux), est basée sur un arrangement
des ions oxygène en mailles cubiques à faces centrées, les ions fer occupant certains sites interstitiels.
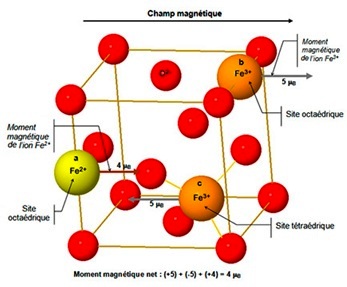
Pour comprendre les propriétés magnétique de la magnétique il suffit de considérer une seule des mailles cubiques à faces centrée
(figure ci-dessous). Des sites octaédriques, entourés par six ions oxygène, se trouvent au milieu des arrêtes et au centre de la maille.
Un ion Fe2+ (a) et un ion Fe3+ (b) occupent deux de ces sites
octaédriques, l'autre ion Fe3+ (c) occupe un site
tétraédrique.
| Lorsque les cristaux de magnétites sont placés dans un champ magnétique :
• le moment magnétique des ions situés dans les sites octaédriques
• le moment magnétique des ions situés dans les sites tétraédriques
Sachant que le moment magnétique d'un ion Fe3+ est de 5 magnétons Le moment magnétique résultant n'est donc pas nul, il est égal à : moment magnétique net = (+5) + (-5) + (+4) = 4 μB |
 |
 |
Si dans la structure de type spinelle, on remplace : l'ion Fe2+ par un autre ion métallique divalent (Mn2+, Co2+, Ni2+...), même si le métal pur n'est pas ferromagnétique, on obtient des
ferrites |
| Pr Robert Valls | robert.valls@univ-amu.fr |