| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

ÉTUDE DES FAMILLES D'ÉLÉMENTS : le bloc p
Correction de l'exercice : La famille du carbone ou colonne 14 ...
Utiliser le diagramme d’Ellingham pour répondre aux questions suivantes :
a- CO peut-il réduire les oxydes de Cu, Ag et Cr ?
b- C peut-il réduire Cr, Mn et Al ?
c- Peut-on faire fondre Al dans un creuset en SiO2 ? Mg dans un creuset en Al2O3 ?
La courbe correspondant à l'équilibre CO→CO2 se situe au-dessous de celle correspondant à l'équilibre Cu→CuO et celle de l'équilibre Ag→Ag2O aussi les deux oxydes pourront être réduits facilement par CO.
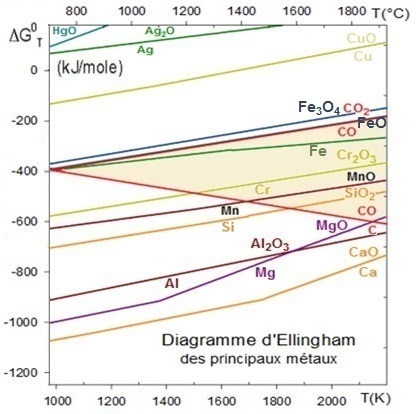 |
Par contre, la courbe correspondant à l'équilibre Cr→Cr2O3 se trouve sous celle correspondant à l'équilibre CO→CO2 et l'oxyde de chrome ne pourra être réduit par CO. Néanmoins, cette courbe croise celle L'oxyde de
manganèse pourra être |
b- Si l'on fait fondre Ca dans un creuset en Al2O3, la courbe d'équilibre Al→Al2O3 étant au dessus de celle de
l'équilibre Ca→CaO,
le calcium va réagir pour donner du CaO et réduire l'alumine en aluminium et attaquer le creuset.
De même, Mg réduit le creuset en alumine mais au-dessus de 1600°C, les courbes se croisent et c'est l'aluminium formé qui peut réduire l'oxyde de Mg mais le creuset ne sera pas reconstitué !
Remarque : l'aluminothermie est une application de la réduction d'un oxyde (dans ce cas, de fer) par un métal (l'aluminium) et on observe une réaction très exothermique autrefois utilisée pour souder des rails sur le terrain. En effet, il suffisait de mélanger de la poudre d'oxyde de fer avec de la poudre d'aluminium, de déposer autour du rail à souder (en protégeant avec du sable par exemple), d'initier la réaction avec une mèche et la réaction étant très exothermique et produisant du fer permettait la soudure. Il suffisait d'enlever l'excédant de fer pour obtenir un rail uniforme.
Pensez à revenir à la page "Connaissances et compétences" pour vérifier vos acquis.
| Pr Robert Valls | robert.valls@univ-amu.fr |