| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... les rayons atomiques ...
Le rayon atomique est le rayon des orbitales atomiques et en général, on définit ce rayon comme la plus grande valeur finie pour
laquelle la densité radiale de probabilité est maximale.
Déterminer par l'expérience la valeur du rayon atomique d'un atome isolé est impossible, généralement, on le calcule.
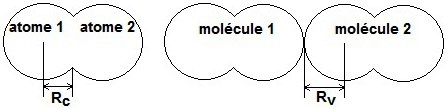 |
On utilise la définition du rayon covalent (RC) qui est égal à la moitié de la distance entre les noyaux de deux atomes de même
type unis l'un à l'autre par une liaison de covalence.
|
Le rayon métallique est défini comme le rayon covalent mais il concerne les distances entre les atomes liés au sein d’un cristal métallique.
En général on raisonne sur le rayon atomique sachant que les conclusions sont comparables pour les autres rayons que l’on vient de définir car leur taille relative est semblable.
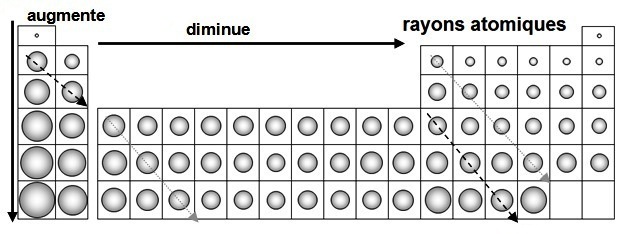 |
Dans cette figure, on a représenté les rayons atomiques des atomes en taille relative et l'on constate que ces rayons atomiques :
• diminue, plus ou moins régulièrement, de gauche à droite
• augmente en parcourant une famille de bas en haut • est stable en parcourant une diagonale uniquement de gauche à droite. |
L’attraction noyau-électron l’emporte sur la répulsion électron-électron et les rayons atomiques ne varient que d’un rapport de 1 à 8 alors que Z varie de 1 à 100.
|
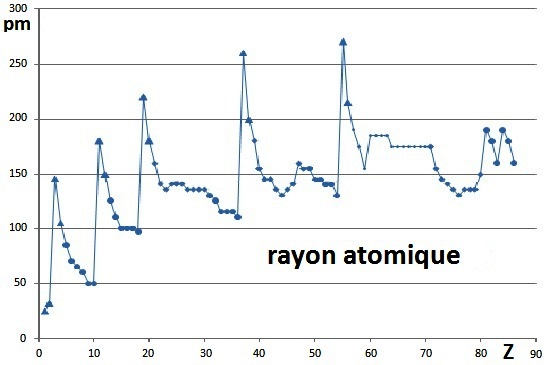
Une autre présentation, sous forme de courbe, proposée dans cette figure, met mieux en évidence
que lorsqu'on change de période on constate une brusque
augmentation du rayon atomique. Cette augmentation est due à l’ajout du premier électron
de la couche suivante. La création d'une nouvelle couche augmente fortement le rayon de l'atome et l’augmentation de l'attraction due à l'ajout d’un proton
dans le noyau ne peut compenser l'augmentation liée à la création de cette nouvelle couche. Ensuite, les électrons s’ajoutent ainsi que les protons, mais c’est l’attraction du noyau qui l’emporte et
globalement le rayon atomique
diminue. |
 |
Par soucis d'homogénéité, la plupart des valeurs numériques sont extraites d'un seul ouvrage dont je peux
vous envoyer les références par courriel.
| Pr Robert Valls | robert.valls@univ-amu.fr |