| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne
J'envoie des
commentaires
sur la ressource
ÉTUDE DES GRANDES FAMILLES DE COMPOSÉS INORGANIQUES
Correction de l'exercice : Les blocs ...
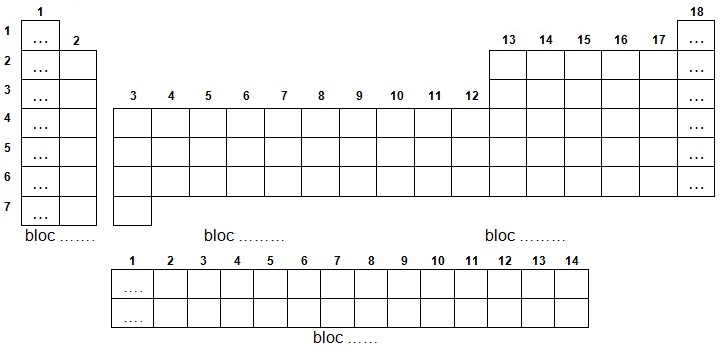
a- On peut découper le tableau périodique en 4 blocs à nommer et à colorer :
b- Que signifient les chiffres indiqués ? Pourquoi vont-ils de 1 à 18, de 1 à 10 et de 1 à 14 ?
c- Donner le numéro atomique des éléments situés dans les cases contenant des pointillés.
Proposer des calculs simples pour vérifier les chiffres de la colonne 18.
a- Dans la classification on observe 4 blocs (s, p, d et f) colorés sur la figure.
b- Les chiffres indiqués de 1 à 18 indiquent les familles chimiques que l'on utilise
couramment, de 1 à 10 numérotent les électrons
du bloc d et de 1 à 14 numérotent les électrons du bloc f.
c- Les numéros atomiques des éléments situés dans les cases contenant
des pointillés s'affichent
sur la figure et on peut commenter
leurs valeurs :
• de 1 à 2, le premier et le second élément, complètent le premier niveau qui ne compte qu'une sous couche s avec 2 électrons
(et donc la première période est complète expliquant les propriétés de gaz rare de He).
Verticalement, à droite, on observe la suite 2, 10, 18, 36, 54 et 86
qui concerne les gaz rares.
Entre chaque chiffre une période est complétée, il faut donc avoir assimilé les règles de remplissage
pour calculer cette suite.
• de 2 à 10, le niveau 2 est rempli, or il compte la 2s et la 2p (2
+ 8 = 10) et le chiffre suivant sera bien 10 électrons (et donc la
deuxième période).
• de 10 à 18, intervient le
niveau
3 qui compte la 3s, la 3p et la 3d mais cette dernière ne se remplie
qu'après la 4s donc s et p (2 + 6 = 8)
et
comme précédemment 10 + 8 = 18 électrons (la troisième période ne compte pas la 3d).
• de 18 à 36, intervient le niveau 4 qui compte
la 4s, la 4p, la 4d et la 4f mais les deux dernières ne se remplissent qu'après la 5s
donc 4s et 4p (2 + 6 = 8) et comme la 3d s'intercale, s, p et d donnent (2 + 6 + 10 = 18) et on obtient 18 + 18 = 36 électrons
(la quatrième période ne compte ni la 4d, ni la 4f mais la 3d).
• de 36 à 54, intervient le
niveau 5 qui compte la 5s, la 5p, la 5d et la 5f (la 5g est hypothétique) mais les deux dernières ne se
remplissent qu'après la 6s donc 5s et 5p (2 + 6 = 8) et comme la 4d s'intercale, s, p et d donnent (2 + 6 + 10 = 18) et
on obtient 36 + 18 = 54 électrons (la cinquième période ne compte ni la
5d, ni la 5f mais la 4d).
• de 54 à 86, intervient le niveau 6 qui
compte la 6s, la 6p, la 6d et la 5f (les 6g et 6h sont hypothétiques) les deux dernières ne
se remplissent qu'après la 7s donc 6s, 6p (2 + 6 = 8) et comme les 5d et 4f s'intercalent, s, p, d et f donnent (2 + 6 + 10 + 14 = 32)
et on obtient 54 + 32 = 86 électrons (la sixième période ne compte ni la 6d, ni la 6f mais
compte la 5d et le 4f).
A gauche, la suite 1, 3, 19, 37, 55 et 87 est équivalente à la précédente moins 1 puisqu'il s'agit des éléments qui précèdent.
Les valeurs 57 et 89 ont été indiquées pour ne pas oublier d'intercaler les orbitales f au bon moment !
Pensez à revenir à la page "Connaissances et compétences" pour vérifier vos acquis.
| Pr Robert Valls | robert.valls@univ-amu.fr |