ALLIAGES ET DIAGRAMMES DE PHASE
Définir ... Compréhension d'un diagramme
à minimum ... Exercice ... Correction
Étude du diagramme d’équilibre solide-liquide d’un binaire AB :
Noter des points sur le graphique de A, B, … comme proposés pour répondre aux questions.
|
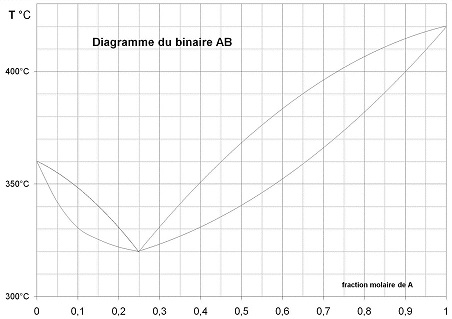 |
a- Voir sur le
graphique
le nom des différentes zones.
b- Le terme solution solide pour un binaire AB signifie que par
exemple B est soluble dans A (partiellement ou en toutes
proportions) et on dit qu'il existe une solution solide de B dans A que
l'on peut coder par SSB.
c- Ce type de diagramme relativement à la miscibilité de A et B est un
diagramme à miscibilité totale.
d- Lorsqu’on refroidit un binaire AB jusqu’à 370°C, on obtient un
mélange
de liquide et de solide.
- composition du solide : XA = 0,73 (point A)
- composition du liquide : XA
= 0,51 (point B)
- La composition qui conduit à 50 % de liquide et 50 % de solide est
XA = 0,62
(point C) |
- température de fusion de l’eutectique est de 320 °C (point D) et sa
composition est : XA
= 0,25
e- On dispose de 80 g d’eutectique qui est composé de 25 % de A et 75 %
de B en molaire.
0,25 mole de A + 0,75 mole de B = 0,25 x 144 + 0,75 x 212 = 195 g
donc dans 80 g d'eutectique, il y a : 80 /
195 = 410 mmol.
0,25 x 410 = 103,5 mmol. de A soit 103,5 x 144 =
14,8 g de A et
0,75 x 410 = 307,5 mmol. de B soit
307,5 x 212 =
65,2 g de B
|
 |
f- L’
alliage
composé de 15% de A est liquide à 340 °C (point E)
- La composition du premier grain de solide est XA
= 0,11 (point F)
- La température à laquelle l’alliage composé de 15 % de A est entièrement solide
est 325 °C (point G)
g- On étudie 80 g d’un
alliage
composé de 70 % de A :
- il est entièrement liquide à 396 °C (point H)
- il est entièrement solide à 366 °C (point I)
On place cet alliage à 380°C :
- la composition en A du solide est XA = 0,78 (point J)
- la composition en A du liquide est XA = 0,57 (point K)
- le % molaire de liquide est : LJ / KJ x 100 = 41,5 % (point L)
- le % molaire de solide est :
KL / KJ x 100 = 58,5 % |
Comme précédemment, le plus simple consiste à calculer en mole :
80 d'un
alliage constitué de 70 % de A représente : 80 / (0,7 x 144 + 0,3 x
212) = 486,6 mmol.
Il y a 58,5 % de solide = 0,585 x 486,6 = 284,6 mmol.
dans le solide :
XA = 0,78 donc 284,6 x 0,78 = 222 mmol. de A
XB = 0,22 donc 284,6 x 0,22 = 62,6 mmol. de B
masse de A dans le solide = 0,2220 x 144 = 32,0 g
masse de B dans le solide =
0,0626 x 212 = 13,2 g |
Il y a 41,5 % de liquide = 0,415 x 486,6 = 201,9 mmol.
dans le liquide :
XA = 0,57 donc 201,9 x 0,57 = 115,1 mmol. de A
XB = 0,43 donc 201,9 x 0,43 = 86,6 mmol. de B
masse de A dans le liquide = 0,1151 x 144 = 16,5 g
masse de B dans le liquide =
0,0866 x 212 = 18,4 g |
Il y a dans l'alliage au total : 32 +
16,5 = 48,5 g de A
et
13,2 + 18,4 = 31,6 g de B
222 + 115,1 = 337,1 mmol. de A
62,6 + 86,6 = 149,2 mmol. de A
337,1 / 486,6 = 0,693 ≈
70 % de A
149,2 / 486,6 = 0,306 ≈
30 % de B
Vérifications : 32,0 + 13,2 + 16,5 +18,4 ≈ 80 g aux approximations près.
Pensez à revenir à la page "Connaissances et compétences" pour vérifier vos acquisitions.
Chimie du solide
Alliages et diagrammes de phase
Compréhension
exercice
Pr Robert Valls & Richard Frèze
robert.valls@univ-amu.fr
