Chimie du solide: 1.1.1
Définir...
Les empilements compacts et non compacts
La matière solide est composée d’atomes, que l’on peut assimiler à des sphères et qui s’assemblent de plusieurs manières :
- les sphères se lient entre elles pour donner des molécules
- les sphères "s’entassent" de manière irrégulière et peuvent glisser les unes sur les autres (les liquides)ou ne bougent pas (matière dite "amorphe" ou "vitreuse")
- les sphères s’entassent de manière ordonnée et sont fixes (cristal). Une grande partie de la matière solide est sous forme cristalline (métaux, oxydes, céramiques, minéraux, sels, polymères...
Les empilements les plus simples concernent les métaux puisque les atomes ont tous la même taille et ne sont pas chargés électriquement.
Les cristaux métalliques sont constitués par une juxtaposition d’atomes identiques, liés par les forces électrostatiques de
Van der Waals, aussi ces cristaux métalliques sont en général malléables (peu durs).
On décrit le modèle du cristal parfait, en considérant un
cristal sans aucun défaut et constitués d'atomes identiques de rayon parfaitement défini et qui sont en contact.
Cependant, pour comprendre ces empilements et pour visualiser leurs propriétés géométriques, on les représente souvent comme des petites
billes reliées par des barres matérialisant la maille.
L'empilement le plus simple est cubique simple, il est représenté ci-dessous :
Cliquer sur la figure pour retrouver l'image initiale
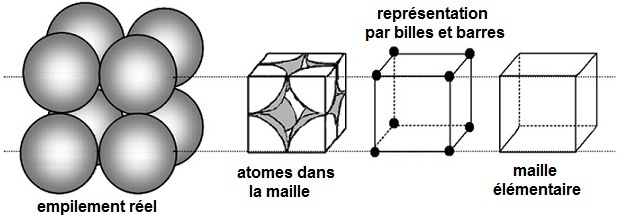
La maille ne contient que le huitième de chaque atome donc 8 x 1/8 = 1 atome (deuxième figure). Chaque atome est en contact avec trois des atomes représentés (dans les trois directions de l'espace). Les sommets de la maille élémentaire sont également les centres des huit atomes.
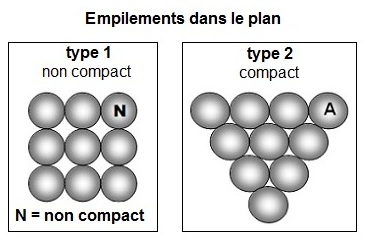
Ce n'est pas l'empilement le plus compact possible car, dans le plan on peut imaginer deux types d'empilement :
- le type 1, que l'on qualifie de non compact pour celui qui présente le plus de vides
- le type 2, que l'on qualifie de compactpour celui qui présente le moins de vides.
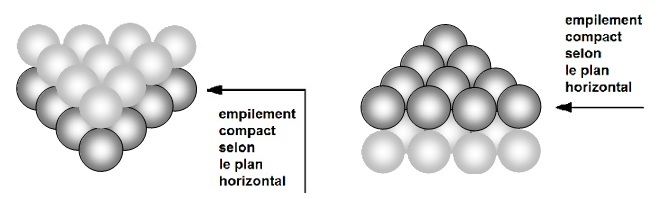
Plusieurs plans de type 1 ou 2 peuvent s'empiler pour constituer un volume. Ils peuvent s'empiler de façon non compacte et conduisent alors à la
première figure pour les type 1 et au volume représenté ci-dessous pour le type 2.
Ce type d'empilement est peut courant mais permet de bien visualiser la notion d'empilement
compact dans le plan (horizontalement)ou
non compacten volume (verticalement).
Cliquer sur la figure pour retrouver l'image initiale
Associée à cette notion d'empilements, on propose la notion de coordinance. Il s'agit du nombre de voisins à égale distance et les plus proches.
Dans l'empilement type 1, la est de 6 car chaque atome est en contact avec un voisin à droite et à gauche, dessus et dessous, devant et derrière soit 6 (selon les trois axes).
Dans l'empilement type 2, la coordinance est de 8 car chaque atome est en contact avec 6 voisin dans le plan (voir la figure) et un dessus et un autre dessous, soit 8. Les autres
atomes ne sont plus en contact et on peut parler de coordinance d'ordre 2, 3, ... en imaginant des sphères concentriques de plus en plus grandes autour de l'atome considéré.