La liaison hydrogène
La liaison hydrogène ou pont hydrogène, est une liaison physique non covalente,
de type
dipôle-dipôle.
Elle est de basse intensité (de dix à vingt fois plus faible que liaison covalente classique) et relie des molécules
en
impliquant un
atome d'hydrogène, elle est à 90% électrostatique.
Bien que de la même famille que les forces de
van
der Waals, les liaisons hydrogène s'en distinguent
par leur intensité :
leur énergie de liaison est
environ cinq à dix
fois supérieure à celle des forces de
van der Waals. C'est donc un type de
liaison à part entière et généralement on
ne la classe pas dans
les liaisons de
van der Waals.
Pour que cette liaison s'établisse, il faut être en présence d'un donneur de liaison hydrogène et d'un
accepteur :
• le donneur est un composé à H acide, c'est-à-dire un hétéroatome (azote, oxygène, fluor)
porteur
d'un
atome hydrogène
(comme dans les amines, alcools, thiols)
• l'accepteur est un hétéroatome (uniquement azote, oxygène ou fluor) porteur de doublets libres.
Lorsqu'une liaison hydrogène s'établit, les deux hétéroatomes se trouvent à une distance d'environ
200
pm.
Exemples : H
Comme les liaisons de valence, la liaison hydrogène est directionnelle : elle s’aligne dans l’axe de la
liaison de valence
qui lui est associée. Cette propriété permet d'avoir des architectures moléculaires
très bien
définies, comme dans
la glace ou dans l'eau à courte distance ou dans les molécules
biologiques telles que les protéines ou l'ADN dont les deux
brins sont liés entre eux par
des liaisons
hydrogène.
L’énergie de formation de la liaison hydrogène est de l'ordre des énergies mises en jeu dans les
fluctuation thermiques à
la température ambiante. Aussi, elles peuvent se tordre, se rompre ou se
former à cette température.
Cette propriété donne aux architectures moléculaires assemblées par
liaisons hydrogène, souplesse et possibilité
d'évoluer à la température ambiante, ce que ne peuvent
faire les liaisons de valence, beaucoup trop énergétiques et
donc complètement rigides à cette même
température. Or, cette souplesse et ces possibilités d'évolution sont
indispensables aux molécules
biologiques. C'est aussi cette souplesse de la liaison hydrogène et la grande polarité de la molécule
d’eau qui vont,
par exemple, permettre à l'eau de construire autour d'un ion un écran de molécules H
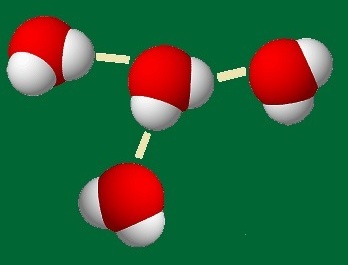
La liaison Hydrogène (comme on l'appelle plus
couramment)
augmente la cohésion
inter-moléculaire
et par exemple, la
température
d'ébullition de la substance qui présente cette
liaison
sera élevée.
Autrement dit, il faudra plus d'énergie (par le biais
de la chaleur)
pour séparer les molécules les unes
des
autres. C'est le cas pour
l'eau (H
Caractéristiques principales de la liaison hydrogène
:
• Seuls les atomes de petite taille et donneur de doublets pourront contracter des liaisons hydrogène
(il faut s'approcher
suffisamment près).
Ce seront essentiellement les atomes d'oxygène et d'azote.
• La formation et la rupture des liaisons hydrogène pourra s'effectuer à des températures proches de
la température
ambiante car l'énergie de ces liaisons est faible (entre
10 et 40
kJ.mol-1) comparée
à l'énergie des liaisons covalentes
(de l'ordre de 400 kJ.mol-1).
• Cette liaison a des conséquences importantes sur la géométrie des molécules biologiques
(elle va
jouer
un rôle non
négligeable dans la structure et la réactivité des
molécules biologiques, en particulier les protéines et les
acides nucléiques).
Les liaisons hydrogène sont en particulier responsables des structures en hélice des
chaînes
polypeptidiques
(liaisons hydrogène NH---O) des protéines et de l'ADN (liaisons hydrogène entre
bases purique et pyrimidique des chaînes de
phosphate désoxyribose).
Remarque : On peut décrire la liaison halogène (XB),
qui est une liaison de nature proche de la
liaison hydrogène (HB).
Elle s'établit
entre les
atomes d'halogènes électro déficients (appauvris en densité électronique),
facilement
polarisables
tels que
l'iode (I) et le brome (Br) et les entités riches en densité électronique
comme les
dérivés azotés et oxygénés
(amines, éthers, amides, ...). Les applications pratiques et
potentielles de
la liaison halogène sont aussi vastes
que celles
de son analogue, la liaison hydrogène.
La liaison halogène est une liaison de faible intensité qui peut se former entre un
atome d'halogène
déficient en densité
électronique (acide de Lewis : I > Br > Cl > F) et un autre
atome
riche en électron
(base de Lewis : O = N > S).
On trouve un grand nombre d'exemples de liaisons halogènes dans les systèmes biologiques.
Par exemple,
l'interaction entre la thyroxine (hormone sécrétée par la tyroïde) et son récepteur est du
type liaison halogène.