
Généralisation de l'hybridation des orbitales atomiques
Par analogie avec ce qui vient d’être vu sur l'hybridation, on peut proposer une géométrie pour les molécules NH
3 et OH2.

L'atome central est entouré de quatre orbitales (une ou deux étant des doublets libres)
qui forment
donc des "tétraèdres"
déformés.
Les doublets libres ayant une répulsion plus grande envers les autres
doublets, les angles de liaison
sont du plus grand au
plus
petit : environ 109° pour CH
Le modèle de Lewis a ses limites et il ne peut, par exemple, expliquer la molécule de pentachlorure
de phosphore, de
formule PCl
Le phosphore P (Z = 15) a la structure électronique [Ne] 3s23p3 et le chlore Cl (Z = 17) [Ne] 3s23p5.
Afin d'expliquer la valence 5 du phosphore il faut tenir compte des énergies voisines des différentes
sous couches 3s, 3p
et 3d.
Le phosphore présente comme le carbone un état "excité" [Ne] 3s13p33d1
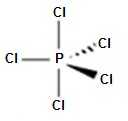 1 orbitale 3s + 3 orbitales 3p + 1 orbitale 3d
donnent
1 orbitale 3s + 3 orbitales 3p + 1 orbitale 3d
donnent
5 orbitales atomiques hybrides que l’on nomme sp3d.
La molécule est en forme de bipyramide à base triangulaire (5 liaisons σ).
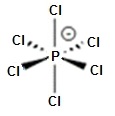 De même l'ion hexachlorophosphore, PCl
De même l'ion hexachlorophosphore, PCl
Dans le bloc d, le nombre de liaisons covalentes possibles pour un atome peut être égal au
maximum, au nombre d’électrons présents dans sa couche de valence.
Les exercices sont proposés dans la
partie suivante "Géométrie des molécules"
car certaines notions sont nécessaires pour pouvoir proposer
des géométries de molécules. Il faut donc bien assimiler cette partie du cours
qui est riche en savoirs pour l'utiliser par la suite.
Atomistique et liaison chimique
La liaison chimique
![]()
Pr Robert Valls
robert.valls@univ-amu.fr