Nomenclature des composés inorganiques
Les éléments (atomes) peuvent être classés en deux catégories principales :
• les éléments métalliques
(ou à prédominance métallique), comme le sodium Na, le magnésium Mg, le zinc Zn, le fer Fe,
le cuivre Cu, le plomb Pb, le mercure Hg, l'argent Ag, ...
• les éléments non-métalliques
(ou à prédominance non-métallique), qui sont moins nombreux : B, C, N, O, F, Si, P, S, Cl, Ge,
As, Se, Br, Sb, Te, I, Po et At
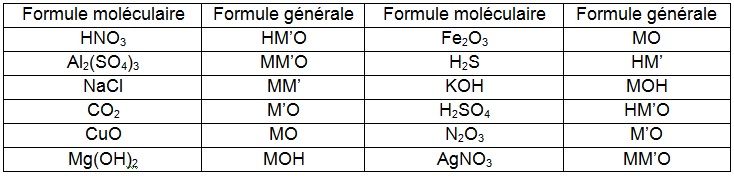
Pour obtenir des formules générales pour les corps purs composés :
• on remplace les symboles des éléments métalliques par le symbole général M
• on remplace les symboles des éléments non-métalliques par le symbole général M’
• on conserve les symboles de l'oxygène O (valence II)
• on conserve les symboles de l'hydrogène H (valence I)
• on supprime les indices et les parenthèses.
On obtient les formules générales suivantes :

On obtient sept catégories pour classer tous les composés minéraux :
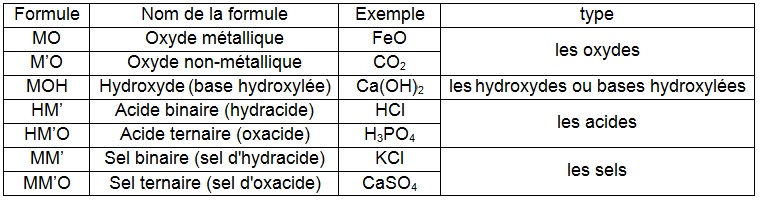
FeO = oxyde de Fer (II) = à préciser car l'ion Fer (III) est possible avec Fe2O3 l'oxyde de Fer (III)
CO2 = dioxyde de carbone = à préciser car le monoxyde de carbone CO existe
Ca(OH)2 = hydroxyde de Calcium = aucune autre précision n'est nécessaire car le seul ion est Ca2+
HCl = chlorure d'hydrogène mais aussi gaz chlorhydrique (donne l'acide chlorhydrique en solution dans l'eau)
H3PO4 = phosphate d'hydrogène = acide phosphorique (il existe l'acide phosphoreux H3PO3 ou phosphite d'hydrogène)
KCl = chlorure de Potassium comme chlorure de Calcium CaCl2 ne demandent aucune précision car les ions sont uniques
CaSO4 = sulfate de Calcium comme sulfate de potassium K2SO4 ne demandent aucune précision car les ions sont uniques