Notions d'hybridation
On a vu que les trois orbitales atomiques p et l’orbitale atomique s se combinent
(s’hybrident) pour donner quatre
orbitales
moléculaires (OM) dites sp3 (combinaison linéaire de 1 orbitale atomique s et de 3 orbitales atomiques p).
Une représentation peut être la suivante :


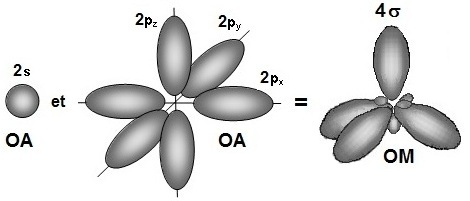
Cette représentation décrit le carbone dit sp3 qui avec
les orbitales 2s1, 2px1, 2py1, 2pz1
donne quatre orbitales hybrides
h1, h'1, h"1 et
h'"1 de même symétrie et qui conduisent à une géométrie tétraédrique.
Mais le carbone présente d'autres géométries :
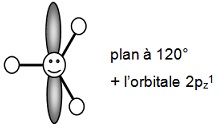 Le carbone dit sp2
qui avec les orbitales 2s1, 2px1, 2py1
Le carbone dit sp2
qui avec les orbitales 2s1, 2px1, 2py1
donne trois orbitales
hybrides h1, h'1, h"1
de même symétrie et qui
conduisent à une géométrie coplanaires à 120°
(l’orbitale 2pz1 donne une liaison π et il y a une double liaison dans la molécule)
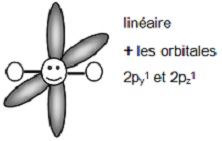 Le carbone dit sp1
ou sp qui avec les orbitales 2s1, 2px1
Le carbone dit sp1
ou sp qui avec les orbitales 2s1, 2px1
donne deux orbitales hybrides h1, h'1 de même symétrie et qui
conduisent à une géométrie linéaire
(2py1 et 2pz1 donnent deux liaisons π et
il y a une triple liaison dans la molécule)
Il s'agit de l'hybridation des orbitales d'un atome mais on n'a pas présenté l'interaction entre les orbitales atomiques
des atomes liés.
On va donc décrire le recouvrement d'orbitales d'atomes liés dans une molécule :
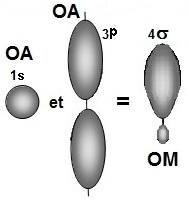
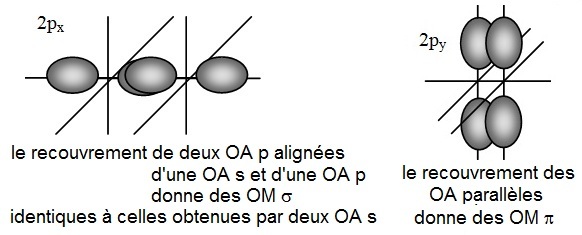
- pour les orbitales s, le recouvrement conduit à une liaison σ qui présente une plus forte densité
électronique entre les
atomes selon le schéma ci-dessous.

- pour les orbitales atomiques p, lorsqu'elles sont alignées, leur recouvrement conduit à une
liaison σ identique à la
précédente,
- mais lorsque les orbitales sont parallèles, le recouvrement conduit à des orbitales moléculaires en deux parties
appelées liaisons π.
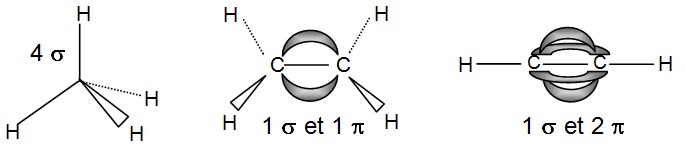
En tenant compte de ces informations on peut proposer la géométrie exacte des molécules qui conduit à des
représentations plus élaborées selon les croquis ci-dessous que l'on ne dessine pas en général mais que l'on doit avoir
à l'esprit en lisant CH4, C2H4
et C2H2 :
On a choisi une représentation la plus simple possible et par convention, on symbolise le recouvrement de deux orbitales
par un trait que les liaisons soient de type σ ou π.
Mais ce sont les liaisons σ qui définissent le squelette de la molécule.
On utilise un simple trait qui relie les deux atomes liés lorsqu'il s'agit d'une liaison σ et un double trait
lorsqu'il s'agit
d'une liaison σ et π et on( obtient la représentation
Sachant qu’il ne peut y avoir généralement que trois liaisons au maximum entre deux atomes.
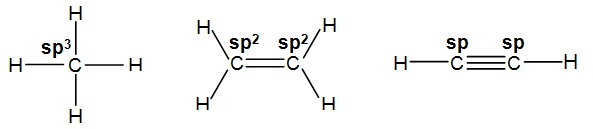
On retient que lorsqu’il y a plus d’un trait entre deux atomes, seul un est une liaison σ, les autres étant des liaisons π.
![]() Conseil : les exercices sont proposés dans les "Généralisation de la règle VSEPR à tous les atomes", mais il est préférable de bien
Conseil : les exercices sont proposés dans les "Généralisation de la règle VSEPR à tous les atomes", mais il est préférable de bien
apprendre cette partie du cours et les suivantes jusqu'à celle qui contient les exercices.
Atomistique et liaison chimique
Géométrie des molécules
![]()
Pr Robert Valls
robert.valls@univ-amu.fr