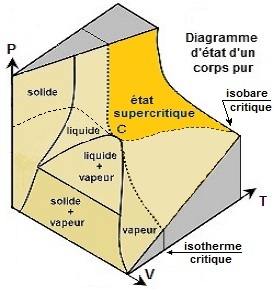
L'état supercritique
Les fluides supercritiques sont produits en chauffant un liquide au-dessus de sa température critique et en comprimant un
gaz au-delà de sa pression critique.
La température critique d’une substance est la température au-delà de laquelle une phase liquide ne peut pas exister,
quelle que soit la pression. La pression de vapeur d’une substance à sa température critique est sa pression critique.
Les fluides supercritiques sont caractérisés par des densités, des viscosités, et d’autres propriétés qui sont
intermédiaires entre celles de l’état gazeux et liquide de la substance.

La zone colorée correspond à l'état supercritique du corps
pur, elle est limitée par l'isotherme critique qui correspond à
la température à partir de laquelle il est impossible de
liquéfier un gaz par simple compression.
Attention, ce diagramme est pédagogique, les diagrammes
réels utilisent souvent des échelles logarithmiques car
certaines zones sont soit très grandes soit très petites.
Le dioxyde de carbone est le fluide supercritique le plus
communément utilisé en raison de sa basse température
critique (31°C), ses propriétés inertes, sa faible toxicité et
réactivité, et enfin sa haute pureté à faible coût.
Il ne dissout pas les molécules polaires, ainsi lors de
l’analyse de ce type de corps composés on peut ajouter
au dioxyde de carbone du méthanol, des éthers cycliques,
de l’eau ou de l’acide formique ...
|
|
Cette partie n'est pas illustrée d'exercices car elle est descriptive, c'est à vous de mémoriser le condensé qui vous y est proposé. |