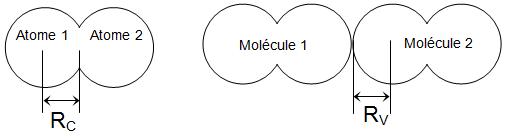
Rayons covalents
Déterminer par l'expérience la valeur du rayon atomique d'un atome isolé est impossible.
Notion assez floue, le rayon atomique peut-être défini comme correspondant à la distance du noyau à laquelle la
probabilité de présence des électrons de valence est maximale. Il est donc fortement dépendant de la valeur du nombre
quantique principal n et croît avec elle. Ceci est d'ailleurs fort bien prévu par le modèle planétaire de Bohr.
On utilise une autre définition qui est celle du rayon covalent (RC),
égal à la moitié de la distance entre les noyaux de
deux atomes de même type unis l'un à l'autre par une liaison de covalence.
Le rayon de Van der Waals (RV) correspond à la distance minimale d'approche de deux molécules.

Le rayon métallique est défini comme le rayon covalent mais il concerne les distances entre des atomes liés au sein d'un
cristal métallique.
La définition du rayon atomique est un peu plus compliquée, on définit le rayon des orbitales atomiques que l’on appelle
rayon atomique.
En général, on définit le rayon atomique comme la plus grande valeur finie pour laquelle la densité radiale de probabilité
est maximale. Le rayon atomique diminue régulièrement
en traversant une période de gauche à droite et augmente
régulièrement en descendant une famille.
Lorsqu'on change de période on constate une brusque
augmentation du rayon atomique entre l'atome d'halogène de la
période n et l'atome de métal alcalin de la période n +1 liée à l'apparition du premier électron de cette couche n +1.
Lorsqu' on descend dans une colonne le rayon atomique augmente régulièrement.
![]() Conseil : un résumé proposé dans "Commenter", mais il est préférable de
bien apprendre cette partie qui est riche en savoirs, le résumé
Conseil : un résumé proposé dans "Commenter", mais il est préférable de
bien apprendre cette partie qui est riche en savoirs, le résumé
étant la trame à partir de laquelle on retrouve l'ensemble du cours.