CONSTRUCTION DE LA CLASSIFICATION PÉRIODIQUE
Définir ...
Affinité électronique
L'affinité électronique (Ae) d'un atome est l'énergie libérée quand il capte un électron, elle est positive lorsque la réaction
d'attachement électronique est exothermique :
(l'ion) X-(gaz) → (l'atome) X(gaz)
+ 1e Ae > 0
C'est une donnée expérimentale qui fournit des renseignements beaucoup moins précis que l'énergie de première
ionisation.
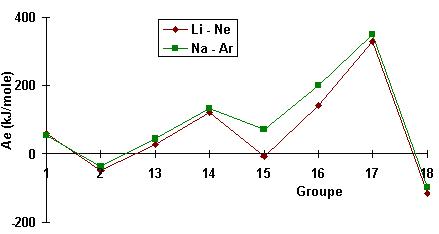 |
L'affinité électronique
augmente
en traversant une
période de gauche à droite mais varie très peu en
descendant une famille (faible écart entre les courbes).
Les deux
familles, alcalino-terreux et gaz rares n'ont
pas d'affinité électronique (on ne connaît pas par exemple
d'anion Mg-)car la couche s pour les premiers et p
pour les seconds est complète et l'ajout d'un électron
dans la sous couche suivante n'est pas stabilisant,
bien au contraire. Pour la colonne
15, la sous couche
p est semi complète (ce qui est stabilisant) et l'ion M-
libère facilement l'électron pour retrouver cette sous
couche semi pleine.
|
Une vue de l'ensemble des éléments permet de visualiser les
trois
colonnes, 2 et 18 pour lesquelles on observe des
valeurs nulles et 15 qui présente une valeur faible par rapport à ses voisins de droite et de gauche.
On visualise également la colonne
12 pour laquelle la sous couche d est complète et qui comme les trois précédentes aura
une affinité électronique nulle.
Les halogènes (colonne 17)
ont la plus grande affinité électronique puisqu'il obtiennent la configuration du gaz rare par
addition d'un électron. De même, la
colonne 11 qui complète
la sous couche d par addition d'un électron présente une
affinité électronique importante.
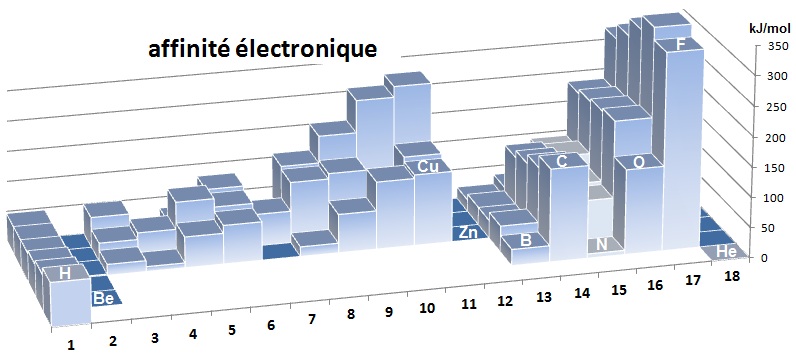
Enfin, la colonne 1 qui complète
la sous couche s par addition d'un électron présente une affinité électronique positive
contrairement à la colonne 2 pour laquelle la sous couche est complète et dont l'ion M- perd très facilement l'électron pour
redonner une sous couche s complète (en fait, l'ion n'existe pas).
 Conseil : un résumé proposé dans "Commenter", mais il est préférable de
bien apprendre cette partie qui est riche en savoirs, le résumé
Conseil : un résumé proposé dans "Commenter", mais il est préférable de
bien apprendre cette partie qui est riche en savoirs, le résumé
étant la trame à partir de laquelle on retrouve l'ensemble du cours.
Atomistique et liaison chimique
Construction de la classification

Pr Robert Valls
robert.valls@univ-amu.fr

