Définir ...
orbitales atomiques et moléculaires
Notion d’hybridation
Le carbone a pour structure électronique 1s2 2s2 2p2 que l'on peut représenter sous forme de cases quantiques
pour mettre en évidence les électrons célibataires
![]() qui sont au
nombre de deux,
qui sont au
nombre de deux,
conduisant à deux liaisons.
On remplit les deux orbitales incomplètes, on obtient
![]() le
monoxyde
de
carbone.
le
monoxyde
de
carbone.
Or nous savons que la chimie du carbone est basée sur la valence 4.
Il a donc été proposé un état
excité du carbone, que l'on peut représenter par ![]()
et dans lequel il y a bien quatre orbitales atomiques (OA) incomplètes
autour du carbone.
Il y a donc 1 orbitale atomique s et 3 orbitales atomiques p et par exemple,
la molécule
CH4 ne peut être
totalement
symétrique (les 4 OA n'étant pas identiques).
Il a été proposé que les trois orbitales atomiques p et l’orbitale atomique s se combinent
(s’hybrident) pour donner quatre
orbitales moléculaires (OM) dites sp3 (combinaison
linéaire de
1 orbitale atomique s et de 3 orbitales atomiques p).
(1s2) 2s2 2p2 donnent (1s2)
2s1 2p3 ou (1s2) 2s2 2px1, 2py1 et 2pz0
à l'état excité on obtient
(1s2) 2s1 2px1, 2py1 et 2pz1
par combinaison des 4 orbitales atomiques (s + 3p), on obtient :
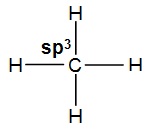 4 OM hybrides de même type nommées h1, h'1, h"1
et h'"1 (qui
donnent des liaisons
4 OM hybrides de même type nommées h1, h'1, h"1
et h'"1 (qui
donnent des liaisons
équivalentes
de type σ) et la molécule
CH4 est donc parfaitement symétrique
(plus de détails sont proposés
dans la suite du cours).
On attribut à cette interprétation l'acronyme anglais L.C.A.O. (combinaison linéaire
d'orbitales atomiques).
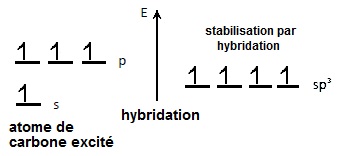 Au niveau énergétique, les orbitales s'hybrident et
Au niveau énergétique, les orbitales s'hybrident et
donnent 4 orbitales de même
énergie qui est
plus
faible que celle des orbitales p et se situe entre
l'énergie de l'orbitale
s et les orbitales p.
On observe que la somme des énergies des 3
orbitales atomiques p et de l'orbitale s est toujours
supérieure à l'énergie des 4 orbitales moléculaires
hybrides obtenues par combinaison linéaire.