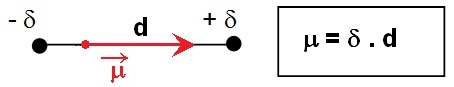 Le vecteur moment dipolaire est
orienté de
Le vecteur moment dipolaire est
orienté de la charge - vers la charge +.
La dissymétrie de charge entre les deux noyaux
est due à la différence d’électronégativité entre
les deux atomes.
Moment dipolaire
La liaison entre deux atomes différents présente en général une dissymétrie de charge entre les deux
noyaux liée à leur
différence d'électronégativité.
On peut assimiler ces atomes à un dipôle :
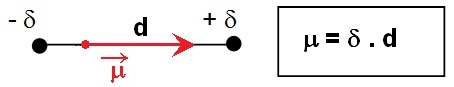 Le vecteur moment dipolaire est
orienté de
Le vecteur moment dipolaire est
orienté de
la charge - vers la charge
+.
La dissymétrie de charge entre les deux noyaux
est due à la différence
d’électronégativité entre
les
deux atomes.
On considère habituellement que lorsque la différence
d'électronégativité
entre les deux
éléments liés dépasse 0,5 unité
dans l'échelle de Pauling, la liaison
est polarisée.
Le caractère ionique d’une liaison est obtenu par :
% de caractère ionique = 100 x μexpérimental / μcalculé
μexpérimental se mesure aussi il est proposé dans des tables.
μcalculé pourrait se nommer
μthéorique ou
μmaximum car il correspond au moment dipolaire qui existe
lorsque la charge
du dipôle est + e et - e (soit lorsque δ = e), c'est à dire que l'on
suppose qu'un atome
a totalement
pris l'électron que l'autre
mettait en commun pour la liaison.
Attention : Cette supposition est totalement théorique puisque
cela correspondrait aux cas des ions et serait régi par les
lois des composés
ioniques. Elle permet, dans ce cas extrême de connaître la
charge (e) et de trouver la valeur maximale
du moment dipolaire.
Il en résulte que : μ = δ x d = e x d
qui est la valeur du moment maximale dipolaire
Supposons que cette valeur soit de 100 et que le moment dipolaire expérimental
soit de 10,
on dira que la liaison
est 100 x 10 / 100 = 10 % ionique et donc 90 % covalente
L’unité de moment dipolaire est le Debye : 1 D = 3,33564.10
-30 C.m.
Définition :
deux charges égales et opposées ayant la charge e et distantes de
1.10
Atomistique et liaison chimique
La liaison chimique
Exercices
![]()
Pr Robert Valls
robert.valls@univ-amu.fr