GÉOMÉTRIE DES MOLÉCULES
Définir ...
Liaison de coordinance
La liaison covalente de coordination
a déjà été décrite comme une liaison
covalente entre deux atomes pour lesquels les
deux électrons partagés dans la liaison proviennent du même atome.
La distinction par rapport à une liaison covalente ordinaire est artificielle, mais c'est la terminologie généralement adoptée
en particulier pour décrire les composés de coordination.
Néanmoins, sa force, sa description et ses propriétés ne sont pas différentes des autres liaisons polaires aussi elle
interviendra dans la géométrie des molécules comme une liaison σ.
Exemples de liaisons de coordinance
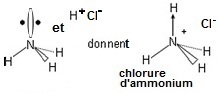 L'ion ammonium, peut être décrit comme NH3 qui
dispose d'un
L'ion ammonium, peut être décrit comme NH3 qui
dispose d'un
doublet libre et joue le rôle de base de Lewis et qui en présence
d'un proton,
donne NH4+. C'est donc quatre liaisons "σ" qui doivent
se répartir autour de l'azote. La molécule sera donc tétraédrique.
Les liaisons de coordination seront donc assimilées aux liaisons σ pour obtenir la géométrie correspondante.
Atomistique et liaison chimique
Géométrie des molécules
Exercices

Pr Robert Valls
robert.valls@univ-amu.fr
 L'ion ammonium, peut être décrit comme NH3 qui
dispose d'un
L'ion ammonium, peut être décrit comme NH3 qui
dispose d'un