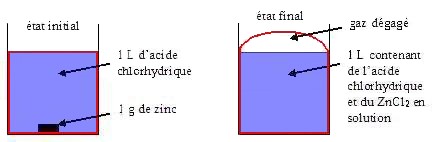
L'état
final sera le système constitué de 1 L d'une solution d'acide chlorhydrique et
de chlorure de zinc
ainsi que du dihydrogène formé
à 25 °C. Il faut donc tenir compte de la capacité
calorifique de la
solution (assimilée à de l'eau pure) et du dihydrogène.

On imagine une enveloppe souple qui colle aux parois et recouvre le dessus de la
solution
(en rouge). Le système à l'état final est constitué de 1 L contenant de l'acide
chlorhydrique
et du chlorure de zinc en solution.
On constate qu'il y au un dégagement gazeux et que le volume du système a varié
(l'enveloppe
souple s'est déformée et elle contient du dihydrogène).
Attention : le litre de solution se retrouve à l'arrivée et ne compte pas dans
la variation de volume
du système. Le volume du système augmente du fait du dégagement gazeux et ΔV > 0
et W < 0.
Remarque : si l'on pose un objet sur le système à l'état initial, le dégagement
gazeux va le soulever,
il reçoit du travail.
Le système donne du travail à l'objet donc le perd et son
signe est bien négatif.
b- Il faut écrire la réaction :
2 HCl (solution) + Zn (solide) → ZnCl2 (solution) + H2
(gaz)
Donc pour une mole de zinc on obtient une mole de dihydrogène.
W = - P . ΔV = - 101325 . Δn . Vmolaire
Vmolaire = 22,4 . 298 / 273 = 24,45 L
Δn = 1 / 65,4 = 15,3 millimoles de Zn donc 15,3 millimoles de H2
W = - 101325 . 0,0153 . 0,02445 = - 38 J (P en Pa ; Δn en mol ; V en m3)
c- Le litre de solution (assimilé à un litre d'eau = 1000 g) a
une capacité calorifique de 1 cal.g-1.K-1
Q = m . c . ΔT = 1000 . 1 . (28 - 25) = + 3000 cal = + 12,54 kJ
Le dihydrogène dégagé libère (même nombre de moles que de Zn
consommé) :
Q = n . c . ΔT = 0,0153 . 29 . (28 - 25) = + 1,33 J (peut être
négligé)
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.