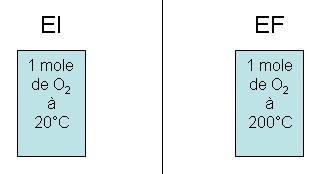

ΔStotale = n . Cv . ln (Tf / Ti) = 1 x 20,9 x ln (473 / 293) = + 10 J.K-1
On va donc supposer que la source d'énergie est à 200°C (ce qui n'est généralement pas le cas car pour
des raisons de rapidité la source est à une température supérieure à celle que doit atteindre ce que l'on doit
chauffer).
Alors ΔSextérieur = Qextérieur / Textérieur = 1 x 20,9 x (200 - 20) / 473 = + 8 J.K-1
On en déduit ΔSsystème = ΔStotale - ΔSextérieur = (+ 10) - (+ 8) = 2 J.K-1
Attention, sans cette supposition et sans d'autres informations, on ne peut calculer que la variation
d'entropie totale.
Pensez à revenir à la page
"Savoirs et savoir faire"
pour vérifier vos acquisitions.