Le système est le kilogramme d'eau, le milieu extérieur est la pièce à 20 °C. En effet, l'eau se refroidit
jusqu'à atteindre celle de puits d'énergie (la pièce).

ΔSextérieur = Qextérieur /
Textérieur
= 1000 x 4,18 x (20 - 90) / 293 = - 998,6 J.K-1
ΔStotale = m . C . ln (Tf / Ti )
= 1000 x 4,18 x ln (293
/ 363) = - 895,5 J.K-1
donc ΔSsystème = ΔStotale -
ΔSextérieur
ΔSsystème = 103,1 J.K-1
On ne donne pas de signe à la variation d'entropie du système car elle est toujours positive (ou nulle).
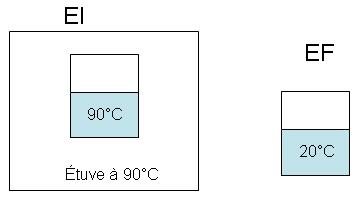
Si l'on analyse les deux expériences :
- on chauffe un kilogramme d'eau à 20 °C dans une étuve à 90 °C
- on refroidit un kilogramme d'eau à 90 °C dans une pièce à 20 °C
Les deux opérations sont irréversibles (ΔSsystème > 0)
et la variation d'entropie du système n'est pas identique dans les deux cas.
On note que la variation d'entropie totale que l'on n'obtient que par une transformation réversible est
dans les deux cas égale mais de signe opposé.
Dans le premier cas, par exemple, la transformation selon un chemin réversible serait obtenue
si l'on
plaçait l'eau à 20 °C dans une étuve à 20 °C et que l'on augmentait la température de l'étuve
de 0,1 °C.
On attendrait que l'eau atteigne 20,1 °C et l'on augmenterait la température de l'étuve de 0,1 °C et
ainsi de suite jusqu'à atteindre 90 °C.
Le calcul des entropies selon des chemins réversibles fait intervenir des variations infinitésimales
et conduit à des intégrales (ce qui explique la présence de la fonction "ln").
Pensez à revenir à la page
"Savoirs et savoir faire"
pour vérifier vos acquisitions.