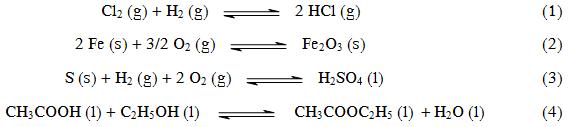
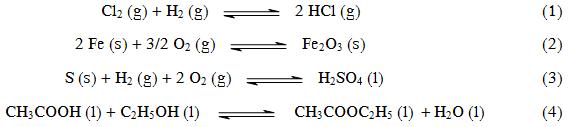
Quelles sont les réactions qui mettent en jeu des équilibres homogènes ?
Donner l'expression des constantes d'équilibre Kc et Kp.
Quelle est l’influence de la pression sur ces équilibres ?
|
P(HCl)2 |
[HCl]2 |
||||
|
Kp = |
——————— |
et |
Kc = |
————— |
|
|
P(Cl2) x P(H2) |
[Cl2] x [H2] |
(2) La deuxième réaction met en jeu
un gaz et des solides et sera donc un équilibre hétérogène.
|
1 |
1 |
||||
|
Kp = |
———— |
et |
Kc = |
——— |
|
|
P(O2)3/2 |
[O2]3/2 |
|
1 |
1 |
||||
|
Kp = |
———————— |
et |
Kc = |
—————— |
|
|
{ P(O2)2 x P(H2) } |
{ [O2]2 x [H2] } |
(4) La quatrième réaction met en jeu un
solide, un liquide et des gaz et sera donc un équilibre
hétérogène.
|
[CH3COOC2H5] x [H2O] |
|||||
|
Kp = |
n'a pas de sens dans ce cas |
et |
Kc = |
——————————— |
|
|
[CH3COOH] x [C2H5OH] |
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.